Строение и функции белков
Содержание:
- Функции белков. Таблица
- Интересные факты
- 1. Белки, участвующие в межклеточной сигнализации
- Где больше всего содержится белка
- Нормы белка
- Ферменты
- Как устроен белок?
- Внутриклеточные регуляторные белки
- Пространственная организация белковых молекул
- Источники белков: животные и растительные белки
- Основные функции
- Роль белков в жизнедеятельности человека
- Сигнальная функция
Функции белков. Таблица
| Функции | Роль |
| строительная | из поступивших извне аминокислот синтезируются присущие данному организму белки |
| структурная | белки служат составляющей всех клеточных органоидов |
| синтезная (каталитическая) | белки выступают ферментами |
| регулирующая (гормональная) | гормоны следят за деятельностью ферментов, контролируют биофизиологические процессы |
| защитная (иммунологическая) | при внедрении в кровь микробов вырабатываются антитела, иммуноглобулины |
| энергетическая | при малом количестве жиров или углеводов разрушаются молекулы белков, выделяя энергию |
| сигнальная (опознавательная) | белки, встроенные на поверхности мембраны, способны менять свою координацию в пространстве в ответ на внешние факторы |
| рецепторная | каждый гормон и физиологически активное соединение имеют свой рецептор |
| транспортная | белки могут прикрепляться к различным веществам и доставлять их из одного отсека клетки в другой |
| двигательная | белки отвечают за сокращение мышц и т.д. миофибриллы – сократительные белки |
| функция образования биокомплексов | биокомплексы регулируют работу внутренних мембран и органелл клетки |
Интересные факты
Некоторые интересные факты о белковых соединениях доказывают важность их в живых организмах. Наиболее интересными считаются следующие:
Наиболее интересными считаются следующие:
- Около 50 % от сухого веса организма приходится на белки.
- Вирусы почти полностью состоят из этого компонента, некоторые на 95 %.
- Более 30 % органических веществ у человека концентрируется в мышцах.
- Клетки головного мозга состоят преимущественно из белковых молекул.
- Волосы на теле и голове человека представлены ороговевшими клетками, состоящими из белковых молекул.
- Недостаток вещества в пище отрицательно отражается на всех процессах.
- В более чем 50 % случаев аллергия на белок у человека проявляется в детском возрасте.
- Человеку одинаково необходим растительный и животный белок.
- Детям белковые соединения необходимы в больших количествах, чем взрослым.
- Яичный белок считается наиболее качественным и легко усваивается.
Белки в организме — незаменимый и необходимый ежедневно компонент, позволяющий обеспечивать здоровье и правильное функционирование клеток.

1. Белки, участвующие в межклеточной сигнализации
Белки-гормоны (и другие белки, участвующие в межклеточной сигнализации) оказывают влияние на обмен веществ и другие физиологические процессы.
Гормоны
— вещества, которые образуются в железах внутренней секреции, переносятся кровью и несут информационный сигнал. Гормоны распространяются безадресно и действуют только на те клетки, которые имеют подходящие белки-рецепторы. Гормоны связываются со специфическими рецепторами. Обычно гормоны регулируют медленных процессы, например, рост отдельных тканей и развитие организма, однако есть и исключения: например, адреналин (см. статью адреналин) — гормон стресса, производное аминокислот. Он выделяется при воздействии нервного импульса на мозговой слой надпочечников.При этом начинает чаще биться сердце, повышается кровяное давление и наступают другие ответные реакции. Также он действует на печень(расщепляет гликоген). Глюкоза выделяется в кровь, и ее используют мозг и мышцы как источник энергии.
Где больше всего содержится белка
Также стоит разобраться, где больше всего содержится белка в продуктах растительного происхождения. Самые ценные из растительных белков содержатся в гречихе, бобовых, картофеле, рисе и ржаном хлебе.
Сравнительно выгодны в данном отношении мучные изделия с творогом (вареники, сочники) или мясом (пельмени, пирожки с мясом и т. д.), тогда как сочетание теста с рисом и другими крупами менее оправданно.
Биологическая ценность белков возрастает при сочетании зерновых, бобовых и мясомолочных продуктов. Для повышения белковой полноценности питания выпускают хлебобулочные изделия, обогащенные обезжиренным молоком или молочной сывороткой, яичные и молочные макаронные изделия. Также существуют специальные сухие концентраты с высоким содержанием легкоусвояемых белков, используемые для питания тяжелобольных.
Впрочем, в отдельных случаях возникает необходимость ограничить потребление белка, например при недостаточности почек или печени. Для этого используют специальные малобелковые крупяные, макаронные и хлебобулочные изделия.
Нормы белка
В разных источниках норма потребления белка всегда разная, мнения на этот счет разделились. Одна группа считает, что нужно потреблять 1 г белка
на 1 кг веса тела, не больше и не меньше; другая группа думает, что человеку нужно не менее 1,5 г белка
на 1 кг веса тела; третья группа — 2 г
и четвертая — 2,5- 3 г.
Лично мое мнение таково:
1. Если вы обычный человек, не занимающийся никаким видом спорта и ведущий, по большему счету, малоподвижный образ жизни, то ваша суточная норма белка — от 1 до 1,2 г на 1 кг веса тела.
2. Если же вы ведете активный образ жизни: занимаетесь танцами, посещаете фитнес клуб 3-5 раз в неделю, играете в волейбол/футбол/теннис и т.д. при этом еще и работаете, то ваша суточная норма белка должна составлять 1,5-2,5 г на 1 кг вашего веса
.
3. И последний вариант: если ваша работа связана с тяжелым физическим трудом, вы профессионально занимаетесь спортом или вы готовитесь к соревнованиям, то ваша норма по белку может быть более 2,5 г
, но этот момент нужно оговаривать с вашим тренером или наставником.
Давайте теперь рассмотрим, что же ожидает человека, если в его организм поступает недостаточное количество белка.
Ферменты
Ферменты, или энзимы, — особый класс белков, являющихся биологическими катализаторами. Благодаря ферментам биохимические реакции протекают с огромной скоростью. Скорость ферментативных реакций в десятки тысяч раз (а иногда и в миллионы) выше скорости реакций, идущих с участием неорганических катализаторов. Вещество, на которое оказывает свое действие фермент, называют субстратом.
Ферменты — глобулярные белки, по особенностям строения ферменты можно разделить на две группы: простые и сложные. Простые ферменты являются простыми белками, т.е. состоят только из аминокислот. Сложные ферменты являются сложными белками, т.е. в их состав помимо белковой части входит группа небелковой природы — кофактор. У некоторых ферментов в качестве кофакторов выступают витамины. В молекуле фермента выделяют особую часть, называемую активным центром. Активный центр — небольшой участок фермента (от трех до двенадцати аминокислотных остатков), где и происходит связывание субстрата или субстратов с образованием фермент-субстратного комплекса. По завершении реакции фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции. Некоторые ферменты имеют (кроме активного) аллостерические центры — участки, к которым присоединяются регуляторы скорости работы фермента (аллостерические ферменты).
Для реакций ферментативного катализа характерны: 1) высокая эффективность, 2) строгая избирательность и направленность действия, 3) субстратная специфичность, 4) тонкая и точная регуляция. Субстратную и реакционную специфичность реакций ферментативного катализа объясняют гипотезы Э. Фишера (1890 г.) и Д. Кошланда (1959 г.).
Э. Фишер (гипотеза «ключ-замок») предположил, что пространственные конфигурации активного центра фермента и субстрата должны точно соответствовать друг другу. Субстрат сравнивается с «ключом», фермент — с «замком».
Д. Кошланд (гипотеза «рука-перчатка») предположил, что пространственное соответствие структуры субстрата и активного центра фермента создается лишь в момент их взаимодействия друг с другом. Эту гипотезу еще называют гипотезой индуцированного соответствия.
Скорость ферментативных реакций зависит от: 1) температуры, 2) концентрации фермента, 3) концентрации субстрата, 4) рН. Следует подчеркнуть, что поскольку ферменты являются белками, то их активность наиболее высока при физиологически нормальных условиях.
Большинство ферментов может работать только при температуре от 0 до 40 °С. В этих пределах скорость реакции повышается примерно в 2 раза при повышении температуры на каждые 10 °С. При температуре выше 40 °С белок подвергается денатурации и активность фермента падает. При температуре, близкой к точке замерзания, ферменты инактивируются.
При увеличении количества субстрата скорость ферментативной реакции растет до тех пор, пока количество молекул субстрата не станет равным количеству молекул фермента. При дальнейшем увеличении количества субстрата скорость увеличиваться не будет, так как происходит насыщение активных центров фермента. Увеличение концентрации фермента приводит к усилению каталитической активности, так как в единицу времени преобразованиям подвергается большее количество молекул субстрата.
Для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную активность (пепсин — 2,0, амилаза слюны — 6,8, липаза поджелудочной железы — 9,0). При более высоких или низких значениях рН активность фермента снижается. При резких сдвигах рН фермент денатурирует.
Скорость работы аллостерических ферментов регулируется веществами, присоединяющимися к аллостерическим центрам. Если эти вещества ускоряют реакцию, они называются активаторами, если тормозят — ингибиторами.
Как устроен белок?
Молекула белка представляет собой спираль, которая состоит из аминокислотных остатков (аминокислот). Всего в природе насчитывают около 80 аминокислот, но для человеческого организма интересны всего 22 аминокислоты, из которых 12 – это заменимые аминокислоты и 10 – незаменимые. Так вот именно незаменимые аминокислоты представляет для нас наибольший интерес. Сейчас объясню почему.
Для человека очень важно, чтобы с пищей он потреблял все незаменимые аминокислоты, так как они не синтезируются в нашем организме самостоятельно! В этом и есть их главное отличие от заменимых аминокислот. Если наш организм не получает хоть одну незаменимую аминокислоту, то это может стать причиной многих проблем со здоровьем, из-за чего не стоит недооценивать
В первую очередь нам интересны белки, которые по своему аминокислотному составу являются полноценными. Полноценные белки
– это белки, в составе которых присутствуют все незаменимые аминокислоты. Если же в белке отсутствует хотя бы одна незаменимая аминокислота или она представлена в недостаточном количестве, то такой белок считается уже неполноценным.
Итак, какие же продукты представлены полноценным белком, а какие нет?
Полноценные белки
– это в первую очередь белки животного происхождения: яйца, мясо животных, мясо рыбы, морепродукты, молочные продукты и соя (единственный растительный белок, который полностью полноценный).
Неполноценные белки
– это белки растительного происхождения: орехи, бобовые, крупы и некоторые овощи.
Чтобы наш организм работал, как часы, а наша иммунная система была крепкой, нам нужно так выстроить свой суточный рацион питания, чтоб 60% всех потребляемых белков за день были ПОЛНОЦЕННЫМИ, а именно ЖИВОТНОГО происхождения!
А теперь давайте рассмотрим основные функции белков в нашем организме
.
Внутриклеточные регуляторные белки
Белки регулируют процессы, происходящие внутри клеток, при помощи нескольких механизмов:
- взаимодействия с молекулами ДНК (транскрипционные факторы);
- при помощи фосфорилирования (протеинкиназы) или дефосфорилирования (протеинфосфатазы) других белков;
- при помощи взаимодействия с рибосомой или молекулами РНК (факторы регуляции трансляции);
- воздействия на процесс удаления интронов (факторы регуляции сплайсинга);
- влияния на скорость распада других белков (убиквитины и др.).
Белки-регуляторы транскрипции
Транскрипционный фактор
— это белок, который, попадая в ядро , регулирует транскрипцию ДНК, то есть считывание информации с ДНК на мРНК (синтез мРНК по матрице ДНК). Некоторые транскрипционные факторы изменяют структуру хроматина, делая его более доступным для РНК-полимераз. Существуют различные вспомогательные транскрипционные факторы, которые создают нужную конформацию ДНК для последующего действия других транскрипционных факторов. Еще одна группа транскрипционных факторов — это те факторы, которые не связываются непосредственно с молекулами ДНК, а объединяются в более сложные комплексы с помощью белок-белковых взаимодействий.
Факторы регуляции трансляции
Трансляция
— синтез полипептидных цепей белков по матрице мРНК, выполняемый рибосомами. Регуляция трансляции может осуществляться несколькими способами, в том числе и с помощью белков-репрессоров, которые, связываются с мРНК. Известно много случаев, когда репрессором является белок, который кодируется этой мРНК. В этом случае происходит регуляция по типу обратной связи (примером этого может служить репрессия синтеза фермента треонил-тРНК-синтетазы).
Факторы регуляции сплайсинга
Внутри генов эукариот есть участки, не кодирующие аминокислот. Эти участки называются интронами . Они сначала переписываются на пре-мРНК при транскрипции, но затем вырезаются особым ферментом. Этот процесс удаления интронов, а затем последующее сшивание концов оставшихся участков называют сплайсингом (сшивание, сращивание). Сплайсинг осуществляется с помощью небольших РНК, обычно связанных с белками, которые называются факторами регуляции сплайсинга. В сплайсинге принимают участие белки, обладающие ферментативной активностью. Они придают пре-мРНК нужную конформацию. Для сборки комплекса (сплайсосомы) необходимо потребление энергии в виде расщепляемых молекул АТФ, поэтому в составе этого комплекса есть белки, обладающие АТФ-азной активностью.
Существует альтернативный сплайсинг . Особенности сплайсинга определяются белками, способными связываться с молекулой РНК в областях интронов или участках на границе экзон-интрон. Эти белки могут препятствовать удалению одних интронов и в то же время способствовать вырезанию других. Направленная регуляция сплайсинга может иметь значительные биологические последствия. Например, у плодовой мушки
Существуют
несколько видов защитных функций белков:
Физическая
защита. В ней принимает участие коллаген —
белок, образующий основу межклеточного
вещества соединительных тканей (в том
числе костей, хряща, сухожилий и глубоких
слоёв кожи (дермы)); кератин,
составляющий основу роговых щитков,
волос, перьев, рогов и др. производныхэпидермиса.
Обычно такие белки рассматривают как
белки со структурной функцией. Примерами
этой группы белков служат фибриногены итромбины ,
участвующие в свёртывании крови.
Химическая
защита. Связывание токсинов белковыми
молекулами может обеспечивать их
детоксикацию. Особенно важную роль в
детоксикации у человека играют ферменты печени,
расщепляющие яды или переводящие их в
растворимую форму, что способствует
их быстрому выведению из организма .
Иммунная
защита. Белки, входящие в состав крови и
других биологических жидкостей,
участвуют в защитном ответе организма
как на повреждение, так и на атаку патогенов.
Белки системы
комплемента и антитела (иммуноглобулины)
относятся к белкам второй группы; они
нейтрализуют бактерии, вирусы или
чужеродные белки. Антитела, входящие
в состав адаптативной
иммунной системы,
присоединяются к чужеродным для данного
организма веществам, антигенам,
и тем самым нейтрализуют их, направляя
к местам уничтожения. Антитела
могутсекретироваться в
межклеточное пространство или
закрепляться в мембранах
специализированных В-лимфоцитов,
которые называютсяплазмоцитами .
В то время как ферменты имеют ограниченное
сродство к субстрату, поскольку слишком
сильное присоединение к субстрату
может мешать протеканию катализируемой
реакции, стойкость присоединения
антител к антигену ничем не ограничена .
Пространственная организация белковых молекул
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.
Если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 1020. Имея 20 аминокислот, можно составить из них еще большее количество разнообразных комбинаций. В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).
Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов — поверхностных белков нервных клеток.
Источники белков: животные и растительные белки
Источники белка растительного происхождения:
- бобовые – соя, фасоль, чечевица;
- орехи;
- картофель;
- крупы – манка, пшено, перловка, гречка.
Нормы белка для взрослого человека
Потребность человеческого организма в белке напрямую зависит от его физической активности. Чем больше мы двигаемся, тем более быстро протекают в нашем организме все биохимические реакции. Людям, которые регулярно тренируются, требуется белка почти вдвое больше, чем среднестатистическому человеку. Недостаток белка для людей, занимающихся спортом опасен «иссушением» мышц и истощением всего организма!
В среднем норма белка для взрослого человека рассчитывается исходя из коэффициента 1 г белка на 1 кг веса, т. е. примерно 80–100 г для мужчин, 55–60 г для женщин. Спортсменам-мужчинам рекомендуется увеличивать количество потребляемого белка до 170–200 г в сутки.
Правильное белковое питание для организма
Правильное питание для насыщения организма белком заключается в сочетании белков животного и растительного происхождения. Степень усвоения белка из продуктов питания зависит от его происхождения и способа термической обработки.
Так, организмом усваиваются примерно 80% от общего поступления с пищей белков животного происхождения и 60% – растительного. В продуктах животного происхождения содержится большее количество белка на единицу массы продукта, нежели в растительных. Кроме того, в состав «животных» продуктов входят все аминокислоты, а растительные продукты в этом отношении считаются неполноценными.
Основные правила питания для лучшего усвоения белка:
- Щадящий способ кулинарной обработки – варка, приготовление на пару, тушение. Жарка должна быть исключена.
- Рекомендуется употреблять больше рыбы и птицы. Если очень хочется мяса – выбирайте говядину.
- Следует исключить из рациона бульоны, они жирны и вредны. В крайнем случае можно приготовить первое блюдо, используя «вторичный бульон».
Особенности белкового питания для роста мышц
Спортсменам, активно набирающим мышечную массу, следует придерживаться всех вышеизложенных рекомендаций. Большую часть их рациона должны составлять белки животного происхождения. Их следует употреблять в пищу совместно с растительными белковыми продуктами, из которых особое предпочтение нужно отдать сое.
Читайте подробнее какая пища богатая белком.
Необходимо также проконсультироваться с врачом и рассмотреть возможность употребления специальных протеиновых напитков, процент усвоения белка из которых равен 97–98%. Специалист индивидуально подберёт напиток, рассчитает верную дозировку. Это станет приятным и полезным белковым дополнением к силовой тренировке.
Особенности белкового питания, желающим похудеть
Желающим похудеть следует употреблять в пищу животные и растительные белковые продукты
Важно разделить их приём, т. к
время их усвоения разное. Следует отказаться от жирных мясных продуктов, не стоит злоупотреблять картофелем, нужно отдать предпочтение крупам со средним содержанием белка.
Не стоит вдаваться в крайности и «садиться» на белковую диету. Она не всем подходит, ведь полное исключение углеводов приведёт к снижению работоспособности и энергии. Достаточно есть продукты, содержащие углеводы, утром – это придаст энергии в течение дня, во второй половине дня употребляйте белковую нежирную пищу. Для восполнения недостатка энергии вечером организм начнёт сжигать жировые отложения, вместе с тем процесс этот будет безопасен для здоровья организма.
Обязательно включайте нужные и правильно приготовленные белковые продукты в свой рацион. Для организма белок – основной строительный материал! Вкупе с регулярными тренировками, он поможет вам построить красивое спортивное тело!
Основные функции
Принято выделять 11 функций белка:
- Транспортная.
- Строительная
- Регуляторная.
- Защитная.
- Двигательная.
- Сигнальная.
- Запасающая.
- Энергетическая.
- Каталитическая или ферментативная.
- Функция антифриза.
- Резервная или питательная.
Транспортная
Уникальная способность белков заключается в их умении присоединять различные вещества и транспортировать их к тем или иным тканям и органам:
- гемоглобин — белок в крови. Присоединяет к себе кислород и переносит его от легких ко всем органам и тканям, а от них забирает углекислый газ и перевозит обратно в легкие;
- липопротеины (от греческого lípos (Λίπος) — «жир», proteḯni (πρωτεΐνη) — «белок»). Отвечают за транспортировку жира;
- гаптоглобин. Связывает гемоглобин, попадающий в кровь при повреждении эритроцитов, и свободный гемоглобин, образуя комплекс гемоглобин-гаптоглобин. Он поглощается и утилизируется клетками печени. Печень возвращает организму аминокислоты глобина и железо гема;
- трансферрин. Вырабатывается в печени, связывает железо и переносит его по телу.
Белки выступают трансфером ионов кальция, магния, железа, меди и др.
Строительная
Белки участвуют в образовании клеточных и внеклеточных составов:
кератин. Основной компонент в составе волос, ногтей, перьев или копыт;
- коллаген. Главный элемент сухожилий и хрящей;
- эластин. Входит в состав связок;
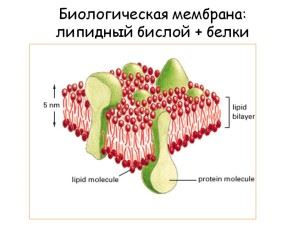
- белки клеточных мембран. В основном это гликопротеины.
Регуляторная
Существует отдельная, довольно крупная группа белков, которая ориентируется на регулирование процессов обмена веществ. В этом принимают участие особые гормоны белковой природы. К примеру, инсулин, который контролирует уровень глюкозы в крови и способствует синтезу гликогена.
Защитная
Включается в случае проникновения в организм чужеродных белков или других микроорганизмов, антигенов. В ответ на нападение образуются специальные белки, антитела, которые выполняют функцию обезвреживания нежелательных веществ.
При кровотечении помогает фибрин, способствующий свертыванию крови.
Двигательная
Белки актин и миозин необходимы для сокращения мышц у многоклеточных организмов и других подвижных функций живых существ.
Сигнальная
На клетках есть мембраны, в которые встроены особые рецепторы. Это белки, которые могут изменять свою третичную структуру в зависимости от внешней среды. Так осуществляется передача команд из внешней среды в клетку.
Запасающая
В случаях длительного голодания организм животных или человека использует белки мышц, эпителиальных тканей и печени для поддержания жизнедеятельности организма.
Кроме того, белки участвуют в откладывании в качестве запаса некоторых веществ. Таким веществом может бы железо, которое не выводится из организма при распаде гемоглобина, а образует комплекс с белком ферритином.
Энергетическая
В качестве источника энергии белки — очень дорогостоящий продукт для нашего тела. Он используется в последнюю очередь, когда израсходованы все углеводы и жиры. При распаде 1 грамма белка выделяется 17,6 кДж энергии. Первым делом они распадаются до аминокислот, а потом до конечных продуктов: воды, углекислого газа и аммиака.
Каталитическая (ферментативная)
Одна из самых важных для организма функций осуществляется за счет особых белков, ферментов (биохимических катализаторов). Они ускоряют биохимические реакции в клетках.
Ферменты можно разделить на:
- Простые. Состоят исключительно из аминокислот.
- Сложные. Помимо белковой части в их состав входит группа небелкового происхождения (кофактор). У некоторых ферментов эту роль играют витамины.
Функция антифриза
У некоторых существ в плазме крови есть белки, которые предупреждают ее замерзание. Такая способность белка является необходимой для выживания в условиях экстремально низких температур.
Питательная (резервная)
Ее выполняют резервные белки, которые становятся для плода источниками питания. В качестве примера можно привести белки яйца (овальбумины) или основной белок молока (казеин).
Роль белков в жизнедеятельности человека
Можно выделить следующие функции белков:
- Строительная. Без белков и их составляющих (аминокислот) невозможно деление клеток, а значит не будет роста и обновления тканей и органов.
- Регулятивная. Белки играют роль «стартера» любого биохимического процесса. Из них состоят почти все гормоны, регулирующие обмен веществ.
- Энергетическая. Белки могут быть использованы как источник энергии.
- Обменная. С помощью белков транспортируется кислород, питательные вещества, гормоны и т. д.
- Функция уникальности. Так как белки составляют наш генетический код, то именно они отвечают за уникальность всех живых существ, определяют внешность человека, его предрасположенности и многое другое.
Отметим, что белки выполняют энергетическую функцию в том случае, если в рационе человека не хватает углеводов.
Сигнальная функция
Сигнальная
функция белков —
способность белков служить сигнальными
веществами, передавая сигналы между
клетками, тканями, о́рганами и разными
организмами. Часто сигнальную функцию
объединяют с регуляторной, так как
многие внутриклеточные регуляторные
белки тоже осуществляют передачу
сигналов.
Сигнальную
функцию выполняют белки-гормоны, цитокины, факторы
роста и
др.
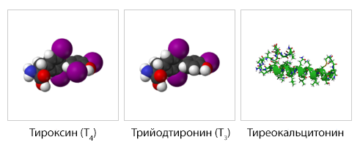
Гормоны
переносятся кровью. Большинство гормонов
животных — это белки или пептиды.
Связывание гормона с рецептором является
сигналом, запускающим в клетке ответную
реакцию. Гормоны регулируют концентрации
веществ в крови и клетках, рост, размножение
и другие процессы. Примером таких белков
служит инсулин,
который регулирует концентрацию глюкозы в крови.
Клетки
взаимодействуют друг с другом с помощью
сигнальных белков, передаваемых через
межклеточное вещество. К таким белкам
относятся, например, цитокины и факторы
роста.
Цитокины —
небольшие пептидные информационные
молекулы. Они регулируют взаимодействия
между клетками, определяют их выживаемость,
стимулируют или подавляют рост,
дифференцировку, функциональную
активность и апоптоз,
обеспечивают согласованность действий
иммунной, эндокринной и нервной систем.
Примером цитокинов может служить фактор
некроза опухоли,
который передаёт сигналы воспаления
между клетками организма .




Белки — это важные молекулы, которые участвуют во многих процессах в организме. Они строятся из аминокислот и выполняют разные функции, такие как участие в строении тканей, передача сигналов внутри клеток и защита организма от инфекций.