Гемопоэз
Содержание:
- I. Кровь — внутренняя среда организма. Состав и функции крови.
- Постэмбриональный гемопоэз
- Кроветворение в антенатальном периоде
- Роль витамина В12 в кроветворении
- СХЕМА КРОВЕТВОРЕНИЯ
- Свойства колониеобразующих тканей
- Васкуляризация. Иннервация. Возрастные изменения. Регенерация.
- Особенности дифференцировки гемопоэтических клеток
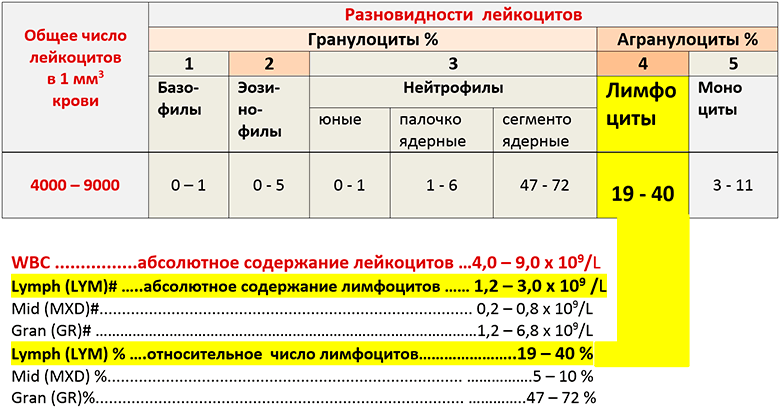
- Белый росток крови
I. Кровь — внутренняя среда организма. Состав и функции крови.
Состав.
Кровь
является
жидкой
тканью,
составляющей
внутренней
среды
организма,
которой
отводится
большая
роль
в
жизнедеятельности.
Общее
количество
крови
в
организме
человека
колеблется
в
пределах
1/11-1/13 общей
массы
тела
(около
7%) и
составляет
в
абсолютных
цифрах
4,5-5 литров.
Кровь
здорового
человека
состоит
на
55% из
жидкой
части
(плазмы)
и
на
45% представлена
различными
форменными
элементами
(гематокритное
число).
Удельный
вес
от
1050 до
1060, Рh
— слабощелочная
(Рh
— 7,4) близкая
к
нейтральной.
Жидкая
часть
крови
— плазма
(содержит
фибриноген,
сыворотка
без
него)
содержит
белки,
углеводы,
липиды,
гормоны,
витамины,
ферменты,
электролиты
(минеральные
вещества),
растворённые
газы,
промежуточные
продукты
обмена
веществ.
Клеточные
элементы
представляют:
эритроциты
(красные
кровяные
тельца),
лейкоциты
(белые
кровяные
тельца),
тромбоциты
(кровяные
пластинки,
самые
маленькие
элементы
крови).
Функции:
дыхательная
— перенос
О2
(кислорода)
к
тканям
и
органам
из
лёгких
и
вынос
из
них
для
выведения
из
организма
СО2
(углекислого
газа0;транспортная
(питательная)
— доставка
к
отдельным
частям
тела
и
органам
питательных
веществ;выделительная
(экскреторная)
— удаление
из
организма
конечных
продуктов
продукта
распада:
креатинин,
мочевина,
аммиак
и
т.д.;поддержание
постоянства
внутренней
среды
организма
(гомеостаза);
даже
самое
незначительное
колебание
кислотно-щелочного
равновесия
(нарушение
баланса
между
содержанием
кислоты
и
щёлочи
в
крови
в
ту
или
иную
сторону)
оказывает
влияние
на
активность
ферментов,
изменяется
скорость
биохимических
процессов;
изменение
кислотности
крови
(содержание
кислоты
и
щелочных
веществ)
при
Рh
выше
7,8 или
ниже
6,8 уже
несовместимо
с
жизнью;защитная
— иммунологические
реакции
(выработка
антител),
участие
в
фагоцитозе;способность
свёртываться
(образовывать
сгусток)
при
повреждении
сосуда.
Постэмбриональный гемопоэз
Постэмбриональный гемопоэз представляет собой процесс физиологической регенерации крови, который компенсирует физиологическое разрушение дифференцированных клеток. Он подразделяется на миелопоэз и лимфопоэз.
Миелопоэз происходит в миелоидной ткани, расположенной в эпифизах трубчатых и полостях многих губчатых костей. Здесь развиваются эритроциты, гранулоциты, моноциты, тромбоциты, а также предшественники лимфоцитов. В миелоидной ткани находятся стволовые клетки крови и соединительной ткани. Предшественники лимфоцитов постепенно мигрируют и заселяют тимус, селезенку, лимфоузлы и некоторые другие органы.
Лимфопоэз происходит в лимфоидной ткани, которая имеет несколько разновидностей, представленных в тимусе, селезенке, лимфоузлах. Она выполняет функции образования T- и B-лимфоцитов и иммуноцитов (например, плазмоцитов).
Миелоидная и лимфоидная ткани являются разновидностями соединительной ткани, т.е. относятся к тканям внутренней среды. В них представлены две основные клеточные линии — клетки ретикулярной ткани и гемопоэтические клетки.
Ретикулярные, а также жировые, тучные и остеогенные клетки вместе с межклеточным веществом формируют микроокружение для гемопоэтических элементов. Структуры микроокружения и гемопоэтические клетки функционируют в неразрывной связи друг с другом. Микроокружение оказывает воздействие на дифференцировку клеток крови (при контакте с их рецепторами или путем выделения специфических факторов).
Таким образом, для миелоидной и всех разновидностей лимфоидной ткани характерно наличие стромальных и гемопоэтических элементов, образующих единое функциональное целое.
СКК относятся к самоподдерживающейся популяции клеток. Они редко делятся. Выявление СКК стало возможным при применении метода образования клеточных колоний – потомков одной стволовой клетки.
Пролиферативную активность СКК регулируют колониестимулирующие факторы (КСФ), различные виды интерлейкинов (ИЛ-3 и др.).
Каждая СКК в эксперименте или лабораторном исследовании образует одну колонию и называется колониеобразующей единицей (сокращенно КОЕ, CFU).
Исследование клеточного состава колоний позволило выявить две линии их дифференцировки.
Одна линия дает начало мультипотентной клетке — родоначальнице гранулоцитарного, эритроцитарного, моноцитарного и мегакариоцитарного рядов гемопоэза (сокращенно КОЕ-ГЭММ).
Вторая линия дает начало мультипотентной клетке — родоначальнице лимфопоэза (КОЕ-Л).
Из мультипотентных клеток дифференцируются олигопотентные (КОЕ-ГМ) и унипотентные родоначальные клетки.
Методом колониеобразования определены родоначальные унипотентные клетки для моноцитов (КОЕ-М), нейтрофильных гранулоцитов (КОЕ-Гн), эозинофилов (КОЕ-Эо), базофилов (КОЕ-Б), эритроцитов (БОЕ-Э и КОЕ-Э), мегакариоцитов (КОЕ-МГЦ), из которых образуются клетки-предшественники. В лимфопоэтическом ряду выделяют унипотентные клетки — предшественницы для B-лимфоцитов и для T-лимфоцитов. Полипотентные (плюрипотентные и мультипотентные), олигопотентные и унипотентные клетки морфологически не различаются.
Все приведенные выше стадии развития клеток составляют четыре основных класса, или компартмента, гемопоэза:
- I класс — СКК — стволовые клетки крови (плюрипотентные, полипотентные);
- II класс — КОЕ-ГЭММ и КОЕ-Л — коммитированные мультипотентные клетки (миелопоэза или лимфопоэза);
- III класс — КОЕ-М, КОЕ-Б и т.д. — коммитированные олигопотентные и унипотентные клетки;
- IV класс — клетки-предшественники (бласты, напр.: эритробласт, мегакариобласт и т.д.).
Сразу отметим, что оставшиеся два класса гемопоэза составляют созревающие клетки (V класс) и зрелые клетки крови (VI класс).
Эритропоэз у млекопитающих и человека протекает в костном мозге в особых морфофункциональных ассоциациях, получивших название эритробластических островков.
Эритробластический островок состоит из макрофага, окруженного одним или несколькими кольцами эритроидных клеток, развивающихся из унипотентной КОЕ-Э, вступившей в контакт с макрофагом. КОЕ-Э и образующиеся из нее клетки (от проэритробласта до ретикулоцита) удерживаются в контакте с макрофагом его рецепторами.
У взрослого организма потребность в эритроцитах обычно обеспечивается за счет усиленного размножения эритробластов. Но всякий раз, когда потребность организма в эритроцитах возрастает (например, при потере крови), эритробласты начинают развиваться из предшественников, а последние — из стволовых клеток.
В норме из костного мозга в кровь поступают только эритроциты и ретикулоциты.
Кроветворение в антенатальном периоде
Кроветворение в антенатальном периоде впервые обнаруживается у 19-дневного эмбриона в кровяных островках желточного мешка, в стебле и хорионе. К 22-му дню первые кровяные клетки проникают в мезодермальную ткань эмбриона, в сердце, аорту, артерии. На 6-й нед. снижается активность К. в желточном мешке. Полностью первый (мезобластический) период гемопоэза, преимущественно эритроцитопоэза, заканчивается к началу 4-го мес. жизни эмбриона. Примитивные кроветворные клетки желточного мешка накапливают гемоглобин и превращаются в примитивные эритробласты, названные П. Эрлихом мегалобластами.
Второй (печеночный) период К. начинается после б нед. и достигает максимума к 5-му мес. К. этого периода преимущественно эритроидное, хотя на 9-й нед. в печени уже созревают первые нейтрофилы. Печеночный период эритроцитопоэза характеризуется исчезновением мегалобластов; при этом эритрокариоциты имеют нормальные размеры. На 3-м мес. эмбриональной жизни в эритроцитопоэз включается селезенка, но у человека ее роль в пренатальном К. ограничена.
На 4-5-м мес. начинается третий (костномозговой) период К. Миелоидный эритроцитопоэз плода — эритробластический и, как и лейкоцитопоэз, мало отличается от эритроцитопоэза взрослого.
Общей закономерностью эмбрионального эритроцитопоэза является постепенное уменьшение размеров эритроцитов и увеличение их числа. Соответственно различным периодам К. (мезобластическому, печеночному и костномозговому) существует три разных типа гемоглобина: эмбриональный, фетальный и гемоглобин взрослого. В основном переход от фетального гемоглобина к гемоглобину взрослого начинается на 3-й нед. жизни плода и заканчивается через 6 мес. после рождения.
В первые дни у новорожденных наблюдается полиглобулия и нейтрофильный лейкоцитоз. Затем активность эритроцитопоэза снижается. Нормализуется он в возрасте 2-3 мес. Нейтрофилез первых дней жизни сменяется лимфоцитозом; только к 5 годам в лейкоцитарной формуле начинают преобладать нейтрофилы.
Роль витамина В12 в кроветворении
В кроветворении принимают участие различные витамины, среди которых особая роль принадлежит витамину В12, содержащему кобальт.
Источником витамина В12 служат продукты животного происхождения; в растительных продуктах он отсутствует. Благодаря этому витамину поддерживается нормальный процесс созревания эритроцитов у здорового человека.
В сутки взрослому человеку необходимо 3—5 мг витамина В12. Как показали современные исследования, витамин В12, попавший в организм с пищей, всасывается в кишечнике лишь при соединении его с особым белком — гастромукопротеином (который иначе называется «внутренний фактор»).
Гастромукопротеин вырабатывается у человека железами желудка и обладает способностью образовывать с витамином В12 комплексное соединение. Оказалось, что этот белок предохраняет витамин от пожирания микроорганизмами, заселяющими кишечник. Таким образом, он выступает в роли «проводника» витамина В12 и спасает его от разрушающего действия микробов.
Всосавшийся витамин накапливается в печени и затем используется для целей кроветворения по мере необходимости.
Установлено, что витамин B12 принимает активное участие в образовании соединений, являющихся составными частями нуклеиновых кислот, — тех самых кислот, коими так богаты ядра клеток и которые определяют основные наследственные признаки организма.
В случае нехватки витамина B12 задерживается синтез нуклеиновых кислот, в результате чего неизбежно нарушается деление постоянно размножающихся кроветворных клеток. Тогда в костном мозге вместо нормальных эритробластов появляются огромные, медленно созревающие клетки, получившие название мегалобластов (от греческого слова «мегалос» — огромный).
СХЕМА КРОВЕТВОРЕНИЯ
Основные положения схемы кроветворения (отсутствие бессмертных «самоподдерживающихся» стволовых клеток, возможность сокращения числа митозов в процессе созревания, клональный характер кроветворения со сменой клонов, наличие ещё не выявленных, более ранних, чем стволовая клетка, предшественников и др.) были многократно подтверждены в течение многих лет. После утраты основного свойства стволовых и только стволовых клеток — способности к самоподдержанию — и невозможности определения самого понятия «стволовости», единственным критерием принадлежности клеток к стволовому отделу остается пролиферативный потенциал, достаточный для мультилинейного восстановления кроветворения после депрессии собственного кроветворения.
Время определения молекулярных основ биологии стволовых клеток ещё не пришло и составить более или менее ясную картину оркестровки генов в ходе кроветворных дифференцировок пока не удаётся.
В нижних этажах кроветворного дерева изменений очень немного. Помимо восьми ранее известных линий кроветворных дифференцировок выделены ещё новые: натуральные киллеры (клетки, участвующие в природном иммунитете, в том числе и против злокачественных клеток) и профессиональные антиген-презентирующие дендритные клетки. В настоящее время различают 11-12 линий дифференцировки кроветворных клеток.
Схему кроветворения (рис. 53-1) мы начинаем с единственного члена отдела тотипотентных предшественников, эмбриональной стволовой клетки (ЭС). Эта клетка способна к образованию клеток всех тканей организма. Эмбриональные стволовые клетки в нормальном развитии не существуют. Их выделяют из внутренней массы бластоциста на стадии примерно 100-120 клеток. В эмбриогенезе эти клетки быстро переходят на следующие стадии дифференцировки. Эмбриональные стволовые клетки образуются только в условиях остановки созревания клеток бластоциста вне организма, например при культивировании в определенных условиях. Дифференцировка клеток бластоциста блокируется и они способны пролиферировать практически бесконечно (больше 120 удвоений) без дифференцировки, без малигнизации, без изменений кариотипа и др. Снятие блока приводит к беспорядочной дифференцировке эмбриональной стволовой клетки. И хотя до разумного клинического применения эмбриональных стволовых клеток ещё далеко, уже сейчас целесообразно поместить этот предшественник в вершину кроветворной иерархии.
Свойства колониеобразующих тканей
Из соединений могут формироваться предшественники эритроцитов, которые носят название ретикулоцитов, а также эозинофилов, моноцитов и и базофилов. Образование клеток плазмы и Т-лимфоцитов происходит с участием селезенки, тимуса и ткани лимфы. Процессы захвата могут иметь место в селезенке.
Говоря про колониеобразующие ткани, надо указать гемоцитопоэзиндуцирующее микроокружение (ГИМ). В процессе его образования принимают участие элементы, входящие в состав паренхимы костного мозга и стромы. Они отвечают за образование макрофагов, эндотелиоцитов капилляров и более крупных сосудов. Эти компоненты выступают основой для закладки нервно-мышечных тканей. ГИМ передают в клетки специальные сигналы, направленные на регуляцию той или иной функции.
Микроокружение участвует в обеспечении полноценного метаболизма. Гемоцитопоэз состоит из множества сложных этапов. Он отвечает за поддержание постоянства, торможения или ускорения деятельности клеток. Регуляция интенсивности гемопоэза должна происходить сообразно меняющимся потребностям органов и систем. При этом может происходить как торможение, так и ускорение, в зависимости от обстоятельств. Обязательно является поступление информации в виде сигналов. Это обеспечивается нейромедиаторами и гормонами.
Кроветворение будет полноценным, если синтезируется достаточно пластических и энергетических веществ, минералов, витаминов. Регуляция базируется на образовании взрослых клеток из стволовых, расположенных в тканях костного мозга, и гормонов с нейромедиаторами. В нем принимают участие цитокины. Факторы микроокружения способны стимулировать гемопоэз, другие направлены на процесс торможения. Транскрипционные отвечают за внутреннюю регуляцию дифференцировки в клеточных ядрах.
Воздействие на кроветворные стволовые клетки обеспечивается влиянием на них нескольких факторов одновременно. Специфические рецепторы, которые включены в состав клеток крови, испытывают на себе стимулирующее действие указанных веществ и факторов.
Предыдущая
АнатомияЭритроциты в крови где образуются, строение, функции и продолжительность жизни, что значит повышенные эритроциты, какая норма, где в организме человека происходит разрушение эритроцитов
Следующая
АнатомияСтроение уха человека схема с описанием, что расположено в средней части уха, анатомия внутреннего и наружного уха, ушной раковины, барабанная полость
Васкуляризация. Иннервация. Возрастные изменения. Регенерация.
Васкуляризация. Костный мозг снабжается кровью посредством сосудов, проникающих через надкостницу в специальные отверстия в компактном веществе кости. Войдя в костный мозг, артерии разветвляются на восходящую и нисходящую ветви, от которых радиально отходят артериолы. Сначала они переходят в узкие капилляры (2—4 мкм), а затем в области эндоста продолжаются в широкие тонкостенные с щелевидными порами синусы (диаметром 10—14 мкм). Из синусов кровь собирается в центральную венулу. Постоянное зияние синусов и наличие щелей в эндотелиальном пласте обусловливаются тем, что в синусах гидростатическое давление несколько повышено, так как диаметр выносящей вены меньше по сравнению с диаметром артерии. К базальной мембране с наружной стороны прилежат адвентициальные клетки, которые, однако, не образуют сплошного слоя, что создает благоприятные условия для миграции клеток костного мозга в кровь. Меньшая часть крови проходит со стороны периоста в каналы остеонов, а затем в эндост и синус. По мере контакта с костной тканью кровь обогащается минеральными солями и регуляторами кроветворения.
Кровеносные сосуды составляют половину (50%) массы костного мозга, из них 30% приходится на синусы. В костном мозге разных костей человека артерии имеют толстую среднюю и адвентициальную оболочки, многочисленные тонкостенные вены, причем артерии и вены редко идут вместе, чаще врозь.
Капилляры бывают двух типов: узкие 6—20 мкм и широкие синусоидные (или синусы) диаметром 200—500 мкм. Узкие капилляры выполняют трофическую функцию, широкие являются местом дозревания эритроцитов и выхода в кровоток разных клеток крови. Капилляры выстланы эндотелиоцитами, лежащими на прерывистой базальной мембране.
Иннервация. В иннервации участвуют нервы сосудистых сплетений, нервы мышц и специальные нервные проводники к костному мозгу. Нервы проникают в костный мозг вместе с кровеносными сосудами через костные каналы. Далее покидают их и продолжаются как самостоятельные веточки в паренхиме в пределах ячеек губчатого вещества кости. Они ветвятся на тонкие волоконца, которые либо вновь вступают в контакт с костномозговыми сосудами и оканчиваются на их стенках, либо заканчиваются свободно среди клеток костного мозга.
Возрастные изменения. Красный костный мозг в детском возрасте заполняет эпифизы и диафизы трубчатых костей и находится в губчатом веществе плоских костей. Примерно в 12—18 лет красный костный мозг в диафизах замещается желтым. В старческом возрасте костный мозг (желтый и красный) приобретает слизистую консистенцию и тогда называется желатинозным костным мозгом. Следует отметить, что этот вид костного мозга может встречаться и в более раннем возрасте, например при развитии костей черепа и лица.
Регенерация. Красный костный мозг обладает высокой физиологической и репаративной регенерационной способностью. Источником образования гемопоэтических клеток являются стволовые клетки, находящиеся в тесном взаимодействии с ретикулярной стромальной тканью. Скорость регенерации костного мозга в значительной мере связана с микроокружением и специальными ростстимулирующими факторами гемопоэза.
Некоторые термины из практической медицины:
- миелограмма (миело- + греч. gramma запись) — выраженный в форме таблицы или диаграммы результат микроскопии мазка пунктата костного мозга, отражающий качественный и количественный состав ядросодержащих клеток миелоидной ткани.;
- миелоидная реакция (миело- + греч. —eides подобный) — появление в периферической крови малодифференцированных клеток, относящихся к грануло- и эритропоэтическому ряду; наблюдается при метастазах злокачественной опухоли в костный мозг, а также при сепсисе, туберкулезе и некоторых других болезнях;
- остеомиелит (osteomyelitis; остео- + греч. myelos костный мозг + ит; син.: костоеда — устар., паностит) — воспаление костного мозга, обычно распространяющееся на компактное и губчатое вещество кости и надкостницу;
| Часть первая – Общая характеристика, классификация; красный костный мозг | immunesys1.mp37 122 кБ |
| Часть вторая – Вилочковая железа — тимус | immunesys2.mp35 310 кБ |
| Часть третья – Селезенка | immunesys3.mp36 073 кБ |
| Часть четвертая – Лимфатические узлы, лимфоидная ткань слизистых оболочек | immunesys4.mp37 152 кБ |
Особенности дифференцировки гемопоэтических клеток
Кроветворная ткань костного мозга объединяет в своем составе комбинацию морфологически нераспознаваемых гемопоэтических клеток-предшественниц и клеток специфических рядов дифференцировки. Все кроветворные клетки, нераспознаваемые с точки зрения морфологии – это гемопоэтические стволовые клетки, которые могут быть:
- мультипотентными (дифференцируются во всех направлениях);
- полипотентными (развиваются только по некоторым из них);
- унипотентными (следуют только по определенному пути развития).
Другая часть клеток, которые удается распознать морфологически, формируется путем дифференцировки из более молодых предшественников, стремительно развивающихся дальше.
Миелопоэз может протекать в нескольких направлениях:
- мегакариоцитарное;
- эритроцитарное;
- моноцитарное;
- гранулоцитарное.
Лимфопоэз включает в себя две основные линии дифференцировки – образование лимфоцитов Т- и В-клеточного ряда. Каждая из них проходит в два этапа. Первый из них является антиген-независимым и заканчивается продукцией структурно зрелых, но иммунологически неактивных лимфоцитов. Следующий этап начинается после контакта с потенциальным антигеном и завершается выработкой специализированных иммунных клеток (Т-киллеров, Т-хелперов, Т-супрессоров, плазматических клеток, клеток памяти).
Каждый ряд дифференцировки кроветворных клеток дебютирует со стадии так называемых «бластов» (например, миелобласты). Для обозначения клеток промежуточного этапа используют приставку «про» и суффикс «цит» (например, проэритрокариоцит). Зрелые клеточные элементы имеют только суффикс «цит» (например, тромбоцит).
Следует отметить, что процесс дифференцировки различных видов клеточных элементов имеет свои особенности. Так, в гранулоцитарном ряде выделяют не одну, а несколько промежуточных стадий. В этом случае вслед за миелобластом образуется промиелоцит, затем миелоцит, метамиелоцит, а только после этого – зрелые клетки – эозинофилы, базофилы, нейтрофилы.
Белый росток крови
Костный мозг оценивается как первичный орган иммунной системы, поскольку является источником В-клеток для вторичных лимфоидных образований периферии — в основном для селезенки и, в меньшей степени, длялимфатических узлов.
Основное назначение костного мозга — продукция клеток крови (кроветворение) и лимфоцитов.
Развитие клеточных элементов костного мозга начинается от плюрипотентной гемопоэтической стволовой клетки (ГСК), которая дает начало шести росткам дифференцировки:
1) Мегакариоцитарному, заканчивающемуся образованием тромбоцитов.
2) Эритроидному, приводящему к формированию безъядерных, переносящих кислородэритроцитов крови;
3) Гранулоцитарному — с тремя дополнительными направлениями дифференцировки, заканчивающимися образованием трех самостоятельных клеточных типов: базофилов,эозинофилов и нейтрофилов.
Эти клетки принимают непосредственное участие в процессахвоспаления и фагоцитоза и являются, таким образом, участниками неспецифической формы защиты.
4) Моноцитарно-макрофагальному. На территории костного мозга дифференцировка в данном направлении завершается образованием моноцитов, мигрирующих в кровь; окончательные зрелые их формы в виде тканевых макрофагов локализуются в различных органах и тканях, где они получили специфические названия: гистиоциты соединительной ткани, звездчатые ретикулоциты печени, макрофаги селезенки, макрофаги лимфатических узлов, перитонеальные макрофаги, плевральные макрофаги, клетки микроглии нервной ткани.
5) Т-клеточному.
Данный росток дифференцировки на территории костного мозга проходит только самый начальный этап развития: формирование предшественника Т-клеток (пре-Т-клеток) от лимфоидной стволовой клетки; основные события по созреванию различных субпопуляций клоноспецифических Т-клеток разворачиваются в тимусе;
6) В-клеточному. В отличие от Т-клеточного направления развития В-клеточная дифференцировка характеризуется практически полной завершенностью; в связи с этим не случайно костный мозг относят к центральному органу иммунитета. Кроме развивающихся B-клеток в постнатальном костном мозге присутствуют зрелыеплазматические и T-клетки.
Следовательно, у человека костный мозг функционирует и как важный вторичный лимфоидный орган. Большинство антигенпрезентирующих клеток также образуется в костном мозге, хотя их гемопоэтический предшественник остается неизвестным.
Морфология костного мозга с возрастом
По мере роста организма красный костный мозг в трубчатых костях постепенно превращается в жировой.
Начинается этот процесс в возрасте 3-4 лет и заканчивается к 14-16 годам.
Гранулоциты
—
клетки, в цитоплазме которых обнаруживается зернистость, специфическая для определенного вида клеток. Различают нейтрофильную, эозинофильную и базофильную зернистость. Нейтрофилы
происходят из полипотентной колониеобразующей единицы нейтрофилов и моноцитов/макрофагов (CFU‑GM), а базофилы
иэозинофилы
— из унипотентных колониеобразующих единиц базофилов (CFU‑B) и эозинофилов (CFU-Eo), соответственно.
По мере дифференцировки размеры клеток уменьшаются, хроматин конденсируется, изменяется форма ядра, в цитоплазме накапливаются гранулы.






Добавить комментарий