Гемоглобинопатия
Содержание:
- Как проходит тестирование?
- Строение[править | править код]
- Примечания[править | править код]
- Методика и техника выявления
- Что такое уровень гемоглобина в крови?
- Строение гемоглобина
- Отличия фетального гемоглобина от гемоглобина А
- Что такое гемоглобин в крови?
- Фетальный гемоглобин
- Разница между гемоглобином и миоглобином
- Диагностическое значение
- Нормы свободного гемоглобина для детей
- Диагностирование заболеваний по результату анализа на белок F
- Функции гемоглобина
- Методы определения гемоглобина в крови: какой подсчет практичнее?
- Расшифровка понятия фетальный гемоглобин
- Нормальные показатели железосодержащего белка
- Что такое гемоглобин?
- Нормальные формы гемоглобина
Как проходит тестирование?
Тест на гемоглобин в сыворотке крови требует небольшого количества крови, которую можно извлечь из руки или руки. Этот процесс обычно занимает всего несколько минут:
- Ваш врач или медсестра будут применять антисептик в районе, где будет нарисована ваша кровь.
- Резинка будет привязана вокруг вашего плеча, чтобы увеличить количество кровотока в венах, заставляя их набухать. Это облегчает поиск вены.
- Затем игла будет вставлена в вашу вену. После того, как вена проколота, кровь будет проходить через иглу в маленькую трубку, прикрепленную к ней. Вы можете почувствовать легкий член, когда игла входит, но сам тест не является болезненным.
- После того, как будет собрано достаточно крови, игла будет удалена, и на месте прокола будет нанесена стерильная повязка.
Собранная кровь затем отправляется в лабораторию для тестирования.
Строение[править | править код]
Гемоглобин является сложным белком класса гемопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Примечания[править | править код]
- ↑ Haemoglobins of invertebrate tissues. Nerve haemoglobins of Aphrodite, Aplysia and Halosydna
- ↑ Ученые выяснили происхождение гемоглобина. РИА Новостей, 20.05.2020, 18:59
- ↑ Michael Berenbrink. Evolution of a molecular machine/Nature, NEWS AND VIEWS, 20 MAY 2020
- ↑ Лауреаты нобелевской премии. Макс Перуц.
- ↑ Назаренко Г. И., Кишкун А. А. Клиническая оценка результатов лабораторных исследований. — 2005.
- ↑ Общий анализ крови и беременность Архивная копия от 10 марта 2014 на Wayback Machine
- ↑ Hall, John E. Guyton and Hall textbook of medical physiology (англ.). — 12th ed.. — Philadelphia, Pa.: Saunders/Elsevier, 2010. — P. 1120. — ISBN 978-1416045748.
- ↑ Степанов В. М. Структура и функции белков : Учебник. — М. : Высшая школа, 1996. — С. 167—175. — 335 с. — 5000 экз. — ISBN 5-06-002573-X.
- ↑ Айала Ф., . Современная генетика: В 3-х т = Modern Genetics / Пер. А. Г. Имашевой, А. Л. Остермана, . Под ред. Е. В. Ананьева. — М.: Мир, 1987. — Т. 2. — 368 с. — 15 000 экз. — ISBN 5-03-000495-5.
Методика и техника выявления
Выраженная Г. может быть определена визуально по интенсивности красной окраски плазмы исследуемой крови. Количественное определение свободного гемоглобина плазмы проводят на фотоколориметре по Бингу в модификации Г. В. Дервиза и Н. К. Бялко (1966). Методика позволяет выявить даже незначительный гемолиз.
Метод основан на выявлении пероксидазных свойств гемоглобина с помощью бензидиновой реакции. Реактивы: ацетатный буфер, перекись водорода и солянокислый бензидин. Кровь для анализа берут из вены сухой иглой и обязательно в силиконированную пробирку с антикоагулянтом. Центрифугируют не более 10 мин. при 1500 об/мин (чтобы не повредить эритроциты). Плазму (после отделения) вновь центрифугируют 10 мин. при 8000 об/мин. В пробирку наливают ацетатный буфер, перекись водорода, раствор бензидина и испытуемую плазму. Смешивают и оставляют стоять на 3 мин. Одновременно готовят контрольный раствор. Фотометрируют при красном светофильтре. Интенсивность голубой окраски нарастает в течение 4—5 мин., поэтому .величину оптической плотности измеряют 3—5 раз и регистрируют максимальные показания. Через 5—6 мин. окраска приобретает лилово-буроватый оттенок и оптическая плотность начинает уменьшаться. Результат берут средний из определения оптической плотности двух параллельных проб.
Количество растворенного гемоглобина в миллиграмм-процентах определяют на калибровочной кривой по оптической плотности.
Что такое уровень гемоглобина в крови?
Для человека уровень железосодержащего белка показатель здоровья организма. Отклонение от нормы легко вычислить с помощью общего анализа крови. Своевременно проведенный анализ не дает возможности точно установить диагноз, но поможет описать общую картину физического состояния человека и составить первоначальные диагностические выводы. Если данного метода недостаточно, назначается биохимия крови, позволяющая получить детальную информацию.
Норма железосодержащего белка для мужчин, женщин и детей различается. Для определения отклонений показателя учитывается пол пациента и возраст.
В разных лабораториях используют любую из систем измерения, поэтому выводы на основании результатов анализа не следует делать самостоятельно. Лучше обратиться за помощью к врачу.
В крови у новорожденных детей обнаружен наиболее высокий предел уровня гемоглобина и иная структура, что не является патологией для младенцев. В процессе взросления показатель падает и приближается к показателю взрослого здорового человека. Изменяется строение железосодержащего белка.
Норма гемоглобина у детей до 12 лет не связана с половой принадлежностью. Различие в показателях появляется с наступлением полового созревания. По сравнению с мужскими показателями уровень железосодержащего белка у женщин ниже на 10%. Узнать нужный показатель можно с помощью приведенной ниже таблицы.
У женщин в силу естественных причин возможны отклонения от нормальных показателей. Например: во время вынашивания ребенка уровень гемоглобина находится ниже общепринятой нормы. На начальных этапах беременности это происходит из-за увеличения объема плазмы в крови будущей мамы. Такое состояние не критическое, и постепенно концентрация гемоглобина придет в норму.
Во втором триместре беременности следует тщательно наблюдать за гемоглобиновым показателем, так как у плода в процессе внутриутробного развития появляется необходимость в железе, которое он получает от организма матери. Данная ситуация представляет опасность, ведь появляется риск анемии у матери, в результате чего мозг плода испытывает недостаток кислорода. Во избежание последствий важен постоянный контроль над содержанием гемоглобина в крови женщины.
Чаще всего понижение железосодержащего белка в крови беременной женщины временное явление и не требует врачебного вмешательства. Однако при длительном и значительном отклонении показателя от нормы необходима консультация специалиста. Обращение к врачу понадобится при следующей симптоматике:
- головные боли и головокружения,
- общая слабость и снижение работоспособности,
- нарушения сна,
- снижение иммунных сил организма,
- сухость кожных покровов и ломкость ногтевой пластины и волос.
Уменьшение гемоглобина ухудшает обменные процессы в организме. Подобное состояние негативно сказывается на здоровье будущей мамы и ребенка.
Строение гемоглобина
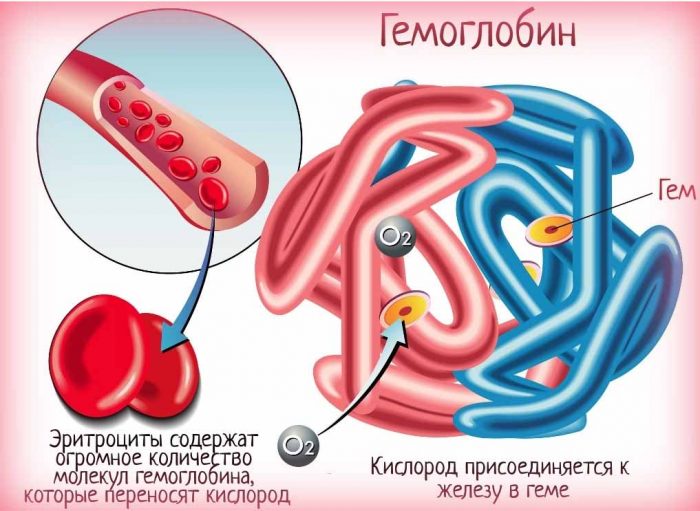
Гемоглобин – это сложный белок. Даже само слово “гемоглобин”, если внимательно присмотреться, сложное. Оно состоит из двух частей – глобина (белковый компонент) и гема (небелковая часть молекулы).
Если рассматривать гемоглобин с точки зрения популярности – то это самая настоящая классика жанра. Откройте любой учебник в разделе “белки”. В 99 случаях из 100, в качестве примера четвертичной структуры белка будет молекула гемоглобина. А рядом картинка такого плана:
В состав гемоглобина входит четыре молекулы гема, каждая из которых буквально обвита белковой цепью. Внутри гема есть один атом железа. Эта структура является пигментом, который окрашивает кровь в привычный нам цвет. Именно за счет гемоглобина наша кровь красная.
Железо в гемоглобине двухвалентное. Не хотелось бы усложнять статью химией, но это важный момент, к которому мы еще вернемся.
Синтез гемоглобина
Синтез гемоглобина происходит в печени, костном мозге, кишечнике и почках. Важную роль в этом процессе играет железо. Часть его организм использует повторно. То есть при распаде гемоглобина большая часть железа остается в организме и идет на построение новых молекул гемоглобина. Немного железа поступает в организм с пищей. Таким образом происходит обновление этого макроэлемента.
Железо откладывается в виде специального белка – ферритина. В составе этого соединения оно трехвалентное. Для того чтобы его превратить в двухвалентную форму, которая как мы помним входит в состав гемоглобина, нужны определенные условия. А именно — наличие таких катализаторов как витамин С и витамины группы В. Без этих веществ и всасывание железа в кишечнике будет весьма затруднительно.
В конце своего жизненного срока (примерно 120 дней), гемоглобин распадается на составляющие. Гем теряет железо, приобретает зеленый оттенок, а затем превращается в желтый билирубин. Билирубин входит в состав желчи, и когда его много, он дает симптомы желтухи. Одним из признаков массового распада гемоглобина является желтушность кожи и склер глаз.
Отличия фетального гемоглобина от гемоглобина А
Основное и самое важное отличие между двумя этими типами гемоглобиновых белков в способности проводить кислород и насыщать им организм. Гемоглобин-F справляется с этой задачей значительно лучше привычного гемоглобина, и на это есть важные причины:
Гемоглобин-F справляется с этой задачей значительно лучше привычного гемоглобина, и на это есть важные причины:
- необходимость для формирующегося плода получать кислород из водной среды, где его содержится значительно меньше, чем в той среде, которая окружает уже родившегося ребенка;
- значительно меньшие, чем у взрослого человека, объемы крови в теле, которая переносит кислород по его органам.
Тем не менее, гемоглобин-F по сравнению с более привычным типом гемоглобина обладает и некоторыми недостатками, делающими его менее устойчивым к воздействию внешней среды.
Это:
- сложности с перенесением им изменений температур;
- сложности с перенесением им изменений уровня кислотности окружающей среды.
Кроме того, при рождении ребенка, предрасположенного к легочным заболеваниям, чрезмерная «открытость» его организма кислороду может вызывать гипоксию и провоцировать развитие проблемы.
Именно эти недостатки в итоге и становятся объяснением тому, почему на смену достаточно эффективно действующему фетальному гемоглобину приходит гемоглобин-A.
Этот тип белка демонстрирует значительно более высокую способность справляться с изменениями, происходящими вокруг организма.
Что такое гемоглобин в крови?
Локализуется гемоглобин в цитоплазме эритроцитов, чем и оказывает влияние на окрас клеток, так как сам является пигментом красного цвета. При этом его содержание составляет более 90% от массы зрелой эритроцитарной клетки. С химической точки зрения молекула гемоглобина характеризуется как сложная четвертичная структура из субъединиц гем и белка глобина. Свою функцию гемоглобин исполняет за счет двухвалентного иона железа, из которого и состоит гем.
Газообмен в тканях имеет основополагающее значение, от которого зависит здоровье и тонус живого организма. И отклонение гемоглобинового показателя от нормы провоцирует развитие патологий.
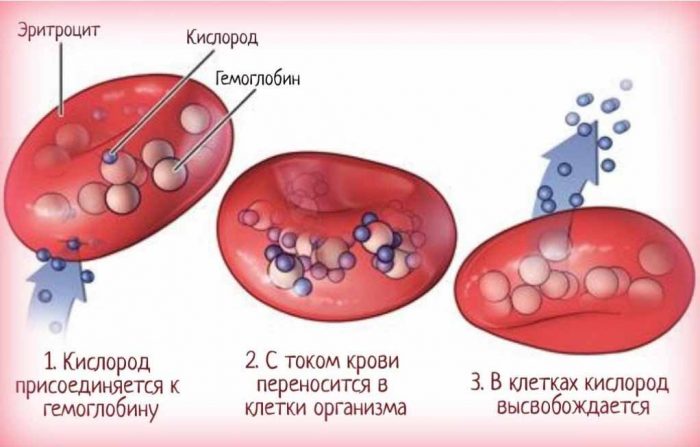
Гемоглобин с помощью эритроцитов перемещается по сосудам, транспортируя кислород, поступивший с дыханием, из легких к клеткам организма и избавляя их от углекислого газа. При этом процессе атом железа захватывает кислород, в результате чего образуется оксигемоглобин. Обратная реакция, когда гемоглобин осуществляет перенос углекислого газа, вызывает образование карбогемоглобина.
Описанные процессы естественные и обратимые функции гемоглобина, в результате которых он меняет структуру из-за присоединения молекул углекислого газа и кислорода. Но возможны иные изменения структуры, что указывает на наличие патологических процессов в организме.
Яркий пример – образование гликированного гемоглобина. Происходит вследствие повышенного содержания глюкозы, которая присоединяется к глобину. При выявлении активного течения процесса предполагают развитие разных типов сахарного диабета.
Внимание! Зачастую вместо термина «гликированный» встречается похожая форма определения «гликозилированный», употребляемая в учебниках и врачами. Однако использование второй формы термина уменьшается, так как верной является первая
Существует еще один вид гемоглобина, называемый фетальным, структура которого отличается от обычного варианта. В большом количестве присутствует у новорожденных, что является нормой. У грудничка к годовалому возрасту его концентрация снижается до минимума. Присутствие фетального гемоглобина в крови у взрослого человека свидетельствует о проблемах со здоровьем.
Другой тип железосодержащего белка – миоглобин. Локализуется в мышечной ткани, образуя там запас, впоследствии используемый организмом в случае гемоглобиновой недостаточности.
За что отвечает гемоглобин в человеческой крови?
Главная цель, выполняемая пигментом, заключается в поддержании газообмена в тканях живого организма. Этот процесс происходит в здоровом организме непрерывно. Если возникает нарушение в его схеме, человек рискует заработать гипоксию.
Транспортировка газов между клетками организма не единственное, на что влияет гемоглобин. Помимо основной задачи в функции гемоглобина входят:
- регулировка вязкости крови за счет нахождения в составе эритроцитов,
- участие белка в регулировании pH крови (буферные свойства гемоглобина).
Фетальный гемоглобин
Фетальный гемоглобин – одна из форм гемоглобинового белка, необходимого для полноценного насыщения организма кислородом. Также его обозначают как гемоглобин-F или попросту HbF – какой бы из этих вариантов не попался, речь будет идти об одном и том же веществе.
Этот тип белка возникает в эритроцитах еще формирующегося ребенка, и потому порой его называют плодный гемоглобин.
Общий цикл его развития в организме выглядит следующим образом:
- Образуется у плода на 9 неделе беременности.
- К 3 месяцу беременности является основным типом гемоглобина в эритроцитах будущего ребенка.
- По-прежнему остается приоритетным непосредственно после рождения.
- Уровень гемоглобина-F в крови резко понижается к 20 дню жизни ребенка.
- В период с 20 до 100 дня снижается еще больше до уровня, который считается нормальным в организме взрослого человека.
Фетальный гемоглобин в крови взрослого человека в целом составляет около 1% от общего количества различных гемоглобиновых белков, среди которых основным является гемоглобин-A. Именно он, приходя на смену фетальному, становится основным источником кислорода.
Разница между гемоглобином и миоглобином
Определение
Гемоглобин: Гемоглобин – это красный белок, который отвечает за транспортировку кислорода в крови позвоночных.
Миоглобин: Миоглобин – это красный белок с гемом, который переносит и запасает кислород в мышечных клетках.
Молекулярный вес
Гемоглобин: Молекулярная масса гемоглобина составляет 64 кДа.
Миоглобин: Молекулярная масса гемоглобина составляет 16,7 кДа.
Состав
Гемоглобин: Гемоглобин состоит из четырех полипептидных цепей.
Миоглобин: Миоглобин состоит из одной полипептидной цепи.
Четвертичная структура
Гемоглобин: Гемоглобин представляет собой тетрамер, состоящий из двух α и двух β субъединиц.
Миоглобин: Миоглобин является мономером. Следовательно, ему не хватает четвертичной структуры.
Количество молекул кислорода
Гемоглобин: Гемоглобин связывается с четырьмя молекулами кислорода.
Миоглобин: Миоглобин связывается только с одной молекулой кислорода.
Кооперативное связывание
Гемоглобин: Поскольку гемоглобин является тетрамером, он проявляет кооперативное связывание с кислородом.
Миоглобин: Поскольку миоглобин является мономером, он не проявляет кооперативного связывания.
Сродство к кислороду
Гемоглобин: Гемоглобин обладает низким сродством к связыванию с кислородом.
Миоглобин: Миоглобин обладает высоким сродством связываться с кислородом, что не зависит от концентрации кислорода.
Связь с кислородом
Гемоглобин: Гемоглобин способен плотно связываться с кислородом.
Миоглобин: Миоглобин не способен тесно связываться с кислородом.
Гемоглобин: Гемоглобин находится в кровотоке.
Миоглобин: Миоглобин находится внутри мышц.
Типы
Гемоглобин: Гемоглобин А, гемоглобин А2 и гемоглобин F являются типами гемоглобина у людей.
Миоглобин: Единственный тип миоглобина обнаружен во всех клетках.
функция
Гемоглобин: Гемоглобин берет кислород из легких и транспортирует к остальной части тела.
Миоглобин: Миоглобин накапливает кислород в мышечных клетках и выделяет при необходимости.
Заключение
Гемоглобин и миоглобин являются двумя связывающими кислород глобулярными белками у позвоночных. Гемоглобин представляет собой тетрамер, который совместно связывается с четырьмя молекулами кислорода. Миоглобин – это мономер, состоящий из одной группы гемов. Поскольку связывающая способность гемоглобина выше, чем у миоглобина, гемоглобин используется в качестве транспортирующего кислород белка в крови. Миоглобин используется в качестве запасающего кислород белка в мышечных клетках. Сродство связывания кислорода с миоглобином выше, чем у гемоглобина. Основное различие гемоглобина и миоглобина заключается в их функции. Функциональное различие гемоглобина и миоглобина возникает из-за разницы их трехмерной структуры.
Диагностическое значение
Выраженная Г. (125—200 мг% и выше) патогномонична для гемолитических анемий, протекающих с внутрисосудистым гемолизом: при острых отравлениях гемолитическими ядами, энзимопенических гемолитических анемиях, пароксизмальной ночной гемоглобинурии, гемолитической болезни новорожденных, а также при гемолитических кризах в результате тяжелых посттрансфузионных реакций, при групповой или резус-несовместимости. При гемолитических анемиях, обусловленных преимущественно внутриклеточным гемолизом, выраженную Г. не обнаруживают. Легкая Г. (до 25 мг%) отмечается при некоторых гемоглобинопатиях (серповидноклеточная анемия и ее варианты, талассемия, гемоглобиноз С), при аутоиммунной гемолитической и пернициозной анемии, резорбции гематом. Легчайшая Г. (5—15 мг%) может иметь место при отравлении концентрированной уксусной к-той и при инфаркте миокарда.
Библиография Алексеев Г. А. и Берлинер Г. Б. Гемоглобинурии, М., 1972; Кассирский И. А. и Алексеев Г. А. Клиническая гематология, М., 1970; М о 1 1 i s о n P. L. Blood transfusion in clinical medicine, Philadelphia, 1972; Wintrobe М. M. Clinical hematology, Philadelphia, 1974.
Нормы свободного гемоглобина для детей
В первые месяцы жизни уровень свободного гемоглобина в крови грудничка превышает 80% от общего показателя. Это связано с быстрым метаболизмом, усиленной работой почек и системы кроветворения, которая перестает зависеть от материнской. Нормальным считается показатель:
- первая неделя до 230 г/л;
- до 6 месяцев понижение до 140 г/л;
- в год после рождения 145–160 г/л.
Кроме возрастных норм, во внимание следует принимать особенности питания, введение или отсутствие прикорма. При анемии у малышей замедляется рост и развитие, плохо набирается вес, ребенок становится более раздражительным и плаксивым
В период полового созревания на уровень начинает влиять и пол, гормональные особенности.
Диагностирование заболеваний по результату анализа на белок F
Информация о количестве фетального и гликированного (а1с) белка, которое может содержать наше тело, помогает при диагностике многих болезней и патологий. К примеру, при беременности количество этих соединений показывает врачу стадию созревания будущего малыша.
Если у рожденного малыша диагностировали гемолитическую анемию, инструкция предполагает использование данных анализа на количество фетального гемоглобина.
По количеству присутствующего в организме фетального гемоглобина специалисты могут определить лейкемию у пациента. Если общий анализ и биохимия крови показали превышение нормы, это расценивается как признак возврата организма к эмбриональной стадии образования крови и появлению большого количества незрелых сформировавшихся клеток.
Еще завышенные показатели данного белкового соединения свидетельствуют о наличие в организме острого дефицита кислорода.
Функции гемоглобина
Пришло время разобраться для чего же нужен гемоглобин в нашем организме. Безусловно, главной задачей гемоглобина является газообмен. Но он занимается не только транспортом жизненно важных газов. Давайте обо всем по порядку.
Итак, функции гемоглобина:
Транспорт кислорода и углекислого газа
Все как нас учили в детстве – гемоглобин насыщается кислородом и по артериям разносит его органам и тканям. А на обратном пути забирает углекислый газ и возвращает его в легкие. Есть, конечно, ньюансы. Забирает гемоглобин почти весь кислород, полученный в легких. А обратно относит максимум 20% углекислого газа. Весь остальной углекислый газ растворяется в плазме крови и достигает легких в несвязанном состоянии. Так что в плане транспорта кислорода роль гемоглобина более существенна.
Поддержание кислотно-щелочного равновесия крови
Для того, чтобы наша кровь, да и весь организм в целом, выполняли свои функции, важно поддерживать постоянство PH. Гемоглобин выводит из клеток кислые соединения, препятствуя их закислению
А в легких, наоборот, предотвращает защелачивание. Таким образом, гемоглобин выполняет функцию буфера.
Связывание токсических веществ
Целый ряд ядовитых веществ имеет высокое сродство к двухвалентному железу. Угарный газ, синильная кислота, анилин, сероводород, нитробензол и другие соединения прочно связываются с железом гемоглобина. Это несколько снижает токсическую нагрузку на организм.
За такую помощь гемоглобина мы платим достаточно высокую цену. Прочные соединения не дают насытить гемоглобин кислородом и организм испытывает гипоксию. Так что с одной стороны гемоглобин, конечно, ограничивает контакт наших органов и тканей с токсинами. С другой же стороны, он не может выполнять свои “прямые обязанности”, и наше здоровье все равно страдает.
Виды гемоглобина
Можно выделить физиологический (нормальный) и патологический гемоглобин.
В медицинской литературе и документации, в том числе и в анализах крови, гемоглобин принято обозначать латинскими буквами Hb (haemoglobinum).
Для обозначения того или иного вида гемоглобина к буквам Hb добавляют еще одну или несколько латинских букв. Они определяют либо химическое соединение, которое вступило в реакцию с гемоглобином, либо являются заглавной буквой слова, которая раскрывает суть вещества. На самом деле все не так уж сложно. Сейчас вы в этом убедитесь.
Физиологический гемоглобин
HbA (adult -взрослый) – это “зрелый” гемоглобин, который есть у каждого человека, в том числе и маленьких детей. При рождении его около 80%, а затем количество HbA повышается до 95-98%.
HBF (fetus — плод) – фетальный гемоглобин, который вырабатывается с 8 недели эмбрионального развития и до рождения. Отличается от HbA большим сродством к кислороду, что вполне оправдано. Ведь малыш должен забрать из крови матери жизненно необходимый кислород.
HbP или HbE (embrion – эмбрион) – этот вид гемоглобина функционирует недолго. Примерно до 8 недели внутриутробного развития. Его иначе называют примитивным гемоглобином.
В зависимости от того, какие вещества присоединил к себе гемоглобин, различают следующие типы гемоглобина:
HbО2 – соединение с кислородом;
HbСО2 – соединение с углекислым газом;
HbMet – гемоглобин, соединившийся с сильным окислителем, и изменивший валентность железа на трехвалентное. В норме такого гемоглобина не должно быть больше 3%.
Патологический гемоглобин
В настоящее время известно более 300 видов патологического гемоглобина. Он может отличаться от нормального как по строению белковой составляющей, так и по наличию токсинов, которые к нему присоединились. Раньше ученые называли каждый тип гемоглобина по буквам латинского алфавита. Например, HbS — гемоглобин серповидно-клеточной анемии. Но потом поняли, что патологических соединений настолько много, что никаких букв не хватит, и начали называть их по другому принципу. К примеру, HbСО – карбгемоглобин (соединение с угарным газом), и так далее.
Говорить о структуре и функциях гемоглобина можно очень много. Оставим подробности ученым, и перейдем к более прикладным вещам – какой уровень гемоглобина считается нормой и о чем говорят его изменения в большую или меньшую сторону.
Анализ крови на гемоглобин
Несколько слов об анализе крови на гемоглобин. Ничего особо сложного тут нет. Определение уровня гемоглобина входит в общий анализ крови. Капиллярная кровь берется из пальца. Кровь нужно сдавать натощак. Накануне исключить физнагрузку. Взрослым желательно не пить воду. Для маленьких детей можно сделать исключение. Вот, собственно, и все.
Методы определения гемоглобина в крови: какой подсчет практичнее?
Гемоглобин (Hb) – молекула, с помощью которой переносится кислород. Она расположена внутри зрелых эритроцитов, лишенных ядер. Клетки получают кислород из альвеол легких, переносят его органам к клеткам-мишеням. От них получают углекислый газ, и переносят его обратно в легочную систему. Без этого действия невозможна жизнь человека. Существуют различные состояния, при которых гемоглобин может повышаться или снижаться. Для диагностики используют различные лабораторные методы определения функции соединения гемоглобина. Их подбирает врач индивидуально для каждого пациента.
Расшифровка понятия фетальный гемоглобин
Фетальным гемоглобином называется соединение гемоглобинового белка, который способствует правильному насыщению нашего организма кислородом. Это вещество образуется в эритроцитах эмбриона, поэтому часто его определяют как плодный гемоглобин.
Гемоглобин f характеризуется конкретной схемой развития в теле:
- Возникает у эмбриона на 9-10 неделе беременности.
- К первому триместру считается главным видом гемоглобина у будущего ребенка.
- Сохраняет приоритетность у новорожденного.
- Резко снижается с 25 дня рождения малыша.
- За временной промежуток с 25 по 105 день жизни грудничка гемоглобин f снижается к норме, допустимой для взрослого человека.
Важно! Безопасный показатель фетального гемоглобина для взрослого должен составлять только один процент от всех гемоглобиновых образований, главным среди которых теперь становится гемоглобин-А. Он заменяет фетальный и обеспечивает человеческому организму требуемое количество кислорода
Ребенок в утробе матери
Нормальные показатели железосодержащего белка
Расшифровкой анализа общеклинического исследования сыворотки крови должен заниматься только врач. Однако выделяют некоторые общие нормы гемоглобина, присущие всем людям. Уровень данного ПС измеряется в г/л (граммы на литр). В зависимости от лаборатории методики анализа могут различаться.
Норма дезоксигемоглобина в крови у различных возрастных групп:
- Мужчины от 18 лет – 120-150 г/л;
- Женщины от 18 лет – 110-130;
- Маленький ребенок – 200;
Повышение или снижение уровня свободного гемоглобина может приводить к патологиям. Первичная гемоглобинопатия обусловлена наследственными причинами, поэтому не лечится на любых этапах развития. Однако существуют методы стабилизации пациентов, поэтому в любом случае нужно обратиться к врачу. При серьезном снижении уровня данного ПС в кровеносном русле показан искусственный кровезаменитель.
Что такое гемоглобин?
Гемоглобин является многосубъединичным глобиновым белком с четвертичной структурой и состоит из четырех полипептидных цепей, двух α и двух β субъединиц. Каждая альфа-цепь состоит из 144 остатков, а каждая бета-цепь состоит из 146 остатков. Противоположные субъединицы, такие как альфа и бета, ассоциируются сильнее, чем аналогичные субъединицы альфа-альфа или бета-бета. Это железосодержащий металлопротеин. В гемоглобине каждая из четырех субъединиц присоединена к небелковой протезной гем-группе, где молекула кислорода связывается. Таким образом, это означает, что гемоглобин может связывать четыре молекулы кислорода с четырьмя гем-группами в каждой цепи. Он имеет низкое сродство к кислороду в своем дезоксигенированном состоянии, но когда первая молекула кислорода связывается с гемоглобином, это приводит к изменению его структуры, что облегчает связывание других молекул кислорода. Этот процесс называется аллостерическим (через пространство) взаимодействием / кооперативностью. Гемоглобин обнаружен в избытке в эритроцитах и дает им красный цвет. Это вовлекает в транспортировку кислорода и углекислого газа к или от всех частей тела. Это также вовлекает метаболизм эритроцитов и также поддерживает pH крови.
Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
- HbР — примитивный гемоглобин, содержит 2 ξ- и 2 ε-цепи, встречается в эмбрионе между 7-12 неделями жизни;
- HbF — фетальный гемоглобин, содержит 2 α- и 2 γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев;
- HbA — гемоглобин взрослых, доля составляет 98 %, содержит 2 α- и 2 β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80 % всего гемоглобина;
- HbA2 — гемоглобин взрослых, доля составляет 2 %, содержит 2 α- и 2 δ-цепи;
- HbO2 — оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98 % от всего количества гемоглобина;
- HbCO2 — карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20 % от всего количества гемоглобина.








Добавить комментарий