Проклятая дюжина
Содержание:
- Особенности устойчивости к дезинфицирующим средствам
- Что влияет на резистентность организма
- Что такое резистентность?
- Ошибка 3. Отсутствие защиты пищеварительной системы
- Резистентность к антибиотикам
- Поколения и резистентность
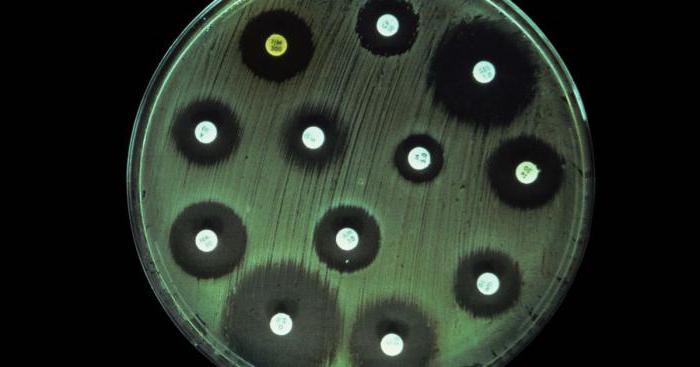
- Для чего нужен анализ на чувствительность к антибиотикам
- Инсулинорезистентность: что это
- Высокий уровень приоритетности
- Как это происходит?
- Проблема антибиотикорезистентности
- Как бактерии приобретают устойчивость?
- Устойчивость к аминогликозидам
- Заключение
Особенности устойчивости к дезинфицирующим средствам
Довольно давно установлено, что микробы могут формировать устойчивость к дезинфектантам. Бактериальная устойчивость к дезинфектантам представляет собой свойство микробов, которое заключается в способности их к размножению и росту в условиях прикосновения к дезинфектантам определенных концентраций. Выделяют естественную и приобретенную бактериальную устойчивость к внешним дезинфектантам.
Известны разнообразные методики исследования микробной устойчивости к дезинфектантам. Наиболее известна методика выяснения устойчивости к дезинфектантам Красильникова А.П., Гудковой Е.И. Подобные методики обеспечивают не только оценку большей части дезинфицирующих средств, но и антибактериальной активности, присущей тем или иным внешним дезинфектантам. Одной из наиболее распространенных является устойчивость бактерий к химическим веществам группы аммониевых соединений.
Для проведения исследования на выявление устойчивости к дезинфектантам применяют чистые бактериальные культуры.
Что влияет на резистентность организма
Способность эффективной сопротивляемости организма человека напрямую зависит от состояния внутренних органов и определенных факторов воздействия – холода, жары, инфекции и пр.
В процессе развития организма противостояние различным условиям, либо инфекциям способно изменяться. Наиболее высокую резистентность отмечают в зрелые годы, а значительное ее снижение отмечается под влиянием различных факторов:
- при неправильном питании, вызывающем ожирение;
- недостатке двигательной активности;
- как следствие стрессов и интоксикации;
- при хроническом нервном и физическом переутомлении.
Кстати, именно эти факторы способны привести к развитию очень неприятной патологии — инсулин резистентности, что, по сути, является состоянием преддиабета 2-го типа.
Что такое резистентность?
Резистентность — это устойчивость микроорганизмов к действию антибиотиков. В организме человека в совокупности всех микроорганизмов встречаются устойчивые к действию антибиотика особи, но их количество минимальное. Когда антибиотик начинает действовать, вся популяция клеток гибнет (бактерицидный эффект) или вовсе прекращает свое развитие (бактериостатический эффект). Устойчивые клетки к антибиотикам остаются и начинают активно размножаться. Такая предрасположенность передается по наследству.
В организме человека вырабатывается определенная чувствительность к действию определенного рода антибиотиков, а в некоторых случаях и полная замена звеньев обменных процессов, что дает возможность не реагировать микроорганизмам на действие антибиотика.
Также в некоторых случаях микроорганизмы и сами могут начать вырабатывать вещества, которые нейтрализуют действие вещества. Такой процесс носит название энзиматической инактивации антибиотиков.
Те микроорганизмы, которые имеют резистентность к определенному типу антибиотиков, могут, в свою очередь, иметь устойчивость к подобным классам веществ, схожих по механизму действия.
Ошибка 3. Отсутствие защиты пищеварительной системы
Антибиотики смертельны не только для болезнетворных бактерий, но и для бактерий, которые колонизируют в пищеварительной системе и полезны для нашего здоровья. Результатом стерилизации организма является постантибиотическая диарея.
В рамках защиты полезных бактерий следует принимать защитные препараты – пробиотики как в виде лекарственных препаратов, так и натуральные – йогурт, кефир. Пробиотические препараты следует принимать примерно через час после введения антибиотика. Они также могут быть использованы после окончания антибиотикотерапии для ускорения восстановления бактериальной флоры в пищеварительной системе.
Посев на флору и антибиотики
Резистентность к антибиотикам
Стремительный рост устойчивости бактерий к антибиотикам представляет серьезную угрозу для здоровья и жизни людей. По статистике ВОЗ, вероятность смертельного исхода заболевания у пациента, инфицированного метициллино-резистентными штаммами стафилококка (MRSA ), на 70% выше, чем у больного, инфицированного обычными, чувствительными к антибиотикам штаммами.
Во многих странах наблюдается тенденция к росту резистентности E. Coli (основного возбудителя инфекций мочевыводящих путей) к фторхинолонам и цефалоспоринам. Все чаще регистрируются случаи устойчивости бактерий к препаратам резерва для данной инфекции (карбапенемы для Klebsiella pneumonia, 3-е поколение цефалоспоринов для гонореи) и т.д. То есть, те заболевания, которые на протяжении многих лет эффективно лечились антибактериальными препаратами сегодня, снова представляют опасность для населения.
В некоторых случаях, тест на чувствительность к антибиотикам показывает частичную или полную устойчивость к большинству «классических» для данной инфекции антибиотиков.
Такая неутешительная картина связана с частым нерациональным и необоснованным применением противомикробных средств. Многие пациенты покупают лекарства не по назначению врача, а по рекомендации друзей, фармацевтов в аптеке, после просмотра рекламы или просто вспомнив, что когда-то этот препарат уже помогал. Также, у многих существуют «любимые» лекарства, которые принимаются по несколько дней при первых признаках заболевания.
Важно понимать, что самоназначение антибиотиков, самостоятельная коррекция назначенных дозировок, кратности приема и длительности курса способствует формированию и распространению бактерий с приобретенной устойчивостью к антибиотикам
Как развивается устойчивость к противомикробным препаратам?
Вторичная (приобретенная) резистентность к антибиотикам развивается за счет спонтанных мутаций в геноме микробной клетки после контакта с противомикробным средством
Важной особенностью данных мутаций является их способность «запоминаться» бактериями и передаваться следующим поколения патогенов. Это способствует быстрому распространению устойчивых штаммов в окружающей среде
Степень резистентности (сниженная чувствительность к антибиотикам или полная устойчивость), а также скорость ее развития зависит от видов и штаммов бактерий.
Быстрее всего под действием антибиотиков мутируют:
- стафилококки (грамположительные кокки);
- эшерихии (грамотрицательные бактерии);
- микоплазмы (внутриклеточные возбудители);
- протей (грам- бактерии);
- синегнойная палочка (грамотрицательные бактерии).
Достаточно редко встречаются антибиотикорезистентные стрептококки группы А, клостридии, сибироязвенные и гемофильные палочки.
Среди механизмов формирования устойчивости, на данный момент наиболее важными считают:
- ферментную инактивацию антибиотика;
- модификацию молекул-мишеней в микробной клетке;
- способность возбудителей активно выводить антибиотик (эффлюкс);
- снижение проницаемости микробной мембраны для лекарства.
Поскольку активное выведение и нарушение проницаемости основаны на ограничении доступа антибиотика в бактериальную клетку, их часто объединяют в один механизм резистентности.
Поколения и резистентность
Существует 4 поколения антибактериальных медикаментов. Последнее поколение демонстрирует наибольшую эффективность. В структуре противомикробных таблеток или уколов находится множество сложных элементов. Препараты 4 поколения обладают не только большей лекарственной эффективностью, но и менее токсичны для организма.
Средства последнего поколения принимаются меньшее количество раз в день. Эффект от их использования достигается гораздо быстрее. С их помощью возможно вылечить хроническое заболевание. Ингибирование ферментов микроба у современных препаратов очень высокая. При правильных действиях медикаменты последнего поколения будут эффективны несколько десятилетий.
В больницах часто назначают лекарства 3 и 4 поколения. Простые заболевания поддаются терапии при использовании препаратов 3 поколения. Они обладают большей токсичностью, но приобретаются в аптеке по более выгодной цене. Современное поколение не так широко распространенно и имеет стоимость выше, чем у более устаревших аналогов. Прием самого современного лекарства не всегда целесообразен. Пользоваться необходимо тем медикаментом, который оказывает нужный эффект. Если пренебрегать этим правилом, вызывается резистивность к современным лекарствам.
Пока еще микробы не имеют резистентность к антибиотикам последнего поколения. Хотя в условиях больниц и мест скопления различных патогенных микроорганизмов уже ходят слухи о том, что существуют невероятно устойчивые штаммы стафилококков и стрептококков. Со слов ученых антибиотикорезистентность способна развиваться бесконечно. Более того, об этом процессе было известно до появления первого антибиотика. Это глобальная проблема, так как создавать эффективные препараты все сложнее. Резистентность — особенность живых организмов. Это значит, что, в данный момент создать лекарство, к которому не будет привыкания — невозможно. Однако ученые двигаются в сторону изобретения идеального медикамента. Скорее всего, это будет абсолютно новый класс лекарств.
Принципы применения для предотвращения резистентности
От правильных действий человека зависит, как быстро микробы будут развиваться. Если будет вестись беспорядочный прием противомикробных медикаментов, в нужный момент лекарство просто не подействует. Любые антибиотики по механизму своего действия со временем вызывают резистентность.
Выделяют следующие правила приема антибиотиков:
- всегда заканчивать курс, даже если наступило улучшение;
- принимать медикамент по инструкции или рекомендациям врача;
- после приема проводить профилактику дисбактериоза;
- избегать самостоятельного назначения и использования антибактериальных препаратов.
Если соблюдать это, удастся повысить пользу от терапии и снизить частоту возникновения побочных эффектов. Если микробы будут уничтожены, то резистентность не передастся новым микроорганизмам. Стоит понимать, что соблюдение норм приема антибиотиков необходимо, чтобы при столкновении с серьезной болезнью (бактериальная пневмония, менингит) воздействовать на патогенные инфекции и возбудителей.
Для чего нужен анализ на чувствительность к антибиотикам
Микроорганизмы по отношению к конкретному виду антибиотика могут характеризоваться как чувствительные, условно-устойчивые и устойчивые. Чувствительными патогенными микроорганизмами являются те, что подавляются рекомендованными дозами антибактериального препарата. Условно-устойчивые для подавления требуют увеличение дозы. Активность устойчивых патогенных микроорганизмов не подавляется даже повышенными дозами антибиотика.
Чувствительность микрофлоры к антибиотикам индивидуальна: у разных людей бактерии могут реагировать на одни и те же антибиотики по-разному. Поэтому назначение антибактериальных препаратов на основании лишь среднестатистической картины не всегда дает желаемый лечебный эффект. Между тем любой антибиотик – это серьезное лечебное средство, обладающее побочными действиями. В частности, при его применении гибнут не только патогенные бактерии, но и полезные микроорганизмы. Может получиться ситуация, когда антибиотик уничтожит полезную микрофлору, а возбудитель заболевания не пострадает – по причине его устойчивости к данному антибиотику.
Чтобы обеспечить эффективность проводимого курса антибактериальной терапии, врач должен быть уверен, что назначаемый им антибиотик действительно справится с выявленным возбудителем заболевания. Для этого и нужен анализ на чувствительность к антибиотикам.
Инсулинорезистентность: что это
Чтобы понять, что такое резистентность к инсулину вспомним, что такое инсулин и в чем его особенность. Это гормон, который секретирует главный орган пищеварения – поджелудочную железу.
Основная его роль – контроль концентрации сахара (глюкозы) в крови. Когда в организм с пищей попадают углеводы, химические реакции преобразуют их в глюкозу, которая всасывается кишечником и «выбрасывается» в кровоток.
Естественно, в крови ее уровень увеличивается. Именно этот процесс стимулирует поджелудочную железу к активной секреции инсулина.
Попадая в кровоток, инсулин выполняет роль «транспортного курьера» – доставляет молекулы глюкозы в клетки печени, где они сберегаются в виде полисахарида (гликогена) и используются по мере надобности, как энергетический материал для тканей. Кровь в это время освобождается от излишка глюкозы и в ней восстанавливается оптимальный ее баланс.
Для любого нашего движения необходима постоянная энергетическая подпитка тканей. Но при определенных обстоятельствах, к примеру, при признаках центрального ожирения (больших жировых отложений в зоне живота), повышенной концентрации холестерина или гипертонии, происходит сбой в этой отлаженной системе.
«Двери» тканевых клеток закрываются, их рецепторы не реагируют на инсулин и не пропускают внутрь ни его, ни глюкозу. Это и называют инсулинорезистентностью.
Если все провокационные факторы развиваются одновременно, то как следствие инсулинорезистенции (когда накапливается высокий уровень не использованного по назначению инсулина) происходит формирование метаболического синдрома (комплекса обменных нарушений).
Отсутствие своевременного лечения, коррекции питания и изменений в образе жизни увеличивает возможность развития состояния преддиабета и характерных признаков 2-го типа сахарного диабета.
Высокий уровень приоритетности
- Enterococcus faecium
- Staphylococcus aureus
- Helicobacter pylori
- Campylobacter spp.
- Salmonellae
- Neisseria gonorrhoeae
Бактерии второй группы объединены по признаку повсеместного распространения, высокой социально-экономической значимости вызываемых ими заболеваний и быстрого развития резистентности к основным антибиотикам, используемым для их эрадикации, однако в резерве еще остается один или несколько эффективных препаратов.
Enterococcus faecium
E. faecium входит в состав нормальной микрофлоры кишечника, но в то же время является условно-патогенным микроорганизмом. У ослабленных больных может вызывать инфекции мочевыводящих путей, раневую инфекцию, сепсис и эндокардит. Резистентен к аминогликозидам, пенициллинам и цефалоспоринам. Беспокойство вызывает снижение чувствительности к ванкомицину — до 72 % в отдельных популяциях. Большинство штаммов E. faecium чувствительны к линезолиду, тигециклину, даптомицину.
Staphylococcus aureus
Золотистый стафилококк, колонизирующий кожу и слизистые оболочки, способен вызывать тяжелые инфекции кожи и мягких тканей, респираторные, раневые инфекции, остеомиелит, сепсис, артрит, эндокардит. Недавнее появление и распространение ванкомицин- и гликопептид-резистентных штаммов в дополнение метициллин-резистентному S. aureus значительно сужает выбор антибактериальных препаратов, однако у возбудителя сохраняется чувствительность к аминогликозидам, эритромицину, тетрациклину, ко-тримоксазолу, линезолиду.
Helicobacter pylori
Тревогу ВОЗ вызывает увеличение случаев резистентности всем известной H. pylori к кларитромицину, что сказывается на эффективности традиционных схем эрадикационной терапии, в том числе и в России. Перед эрадикацией ВОЗ рекомендует проверить чувствительность бактерии к этому антибиотику, при выявлении устойчивости — использовать схемы без него — с метронидазолом, тетрациклином или рифаксимином, а также добавлять висмута трикалия дицитрат.
Campylobacter spp.
Бактерии рода Campylobacter удерживают первое место в мире по гастроэнтеритам, которые у большинства населения планеты протекают в легкой форме, но представляют опасность для маленьких детей, беременных, стариков и иммунокомпрометированных больных. В большинстве случаев достаточно регидратации и восстановления электролитного баланса, антибактериальную терапию назначают при тяжелом течении. Проблемой является резистентность Campylobacter к фторхинолонам, основному средству борьбы с кишечной микрофлорой, и макролидам. Устойчивость к этим препаратам, впрочем, сильно варьирует от страны к стране — от менее 5 % в Финляндии до более 90 % в Индии. В Европе и России эритромицин всё еще остается препаратом выбора. По данным микробилогических исследований, в России также еще вполне актуальны фторхинолоны. В запасе для особо тяжелых случаев с осложнениями — гентамицин и карбапенемы.
Salmonellae
Представители рода сальмонелл также вызывают набор кишечных инфекций, от легкого энтерита до брюшного тифа. Большинство этих бактерий уже резистентны к бета-лактамам, аминогликозидам, тетрациклинам, хлорамфениколу и ко-тримоксазолу. Устойчивость к фторхинолонам растет во всем мире, но пока не привела к полной бесполезности этих препаратов, они остаются антибиотиками выбора, наравне с макролидами и цефалоспоринами третьего поколения. Антибактериальной терапии требуют только тяжелые случаи кишечных инфекций и, конечно, брюшной тиф и паратифы.
Neisseria gonorrhoeae
Гонорея из неприятной, но относительно легко излечимой болезни эволюционировала в глобальную медицинскую проблему. Гонококк потерял чувствительность к пенициллинам, тетрациклинам, сульфаниламидам и фторхинолонам.
Особое опасение вызывает появление и постепенное распространение штаммов, резистентных к цефалоспоринам (цефтриаксону), долгое время служивших безотказным средством борьбы с этой инфекцией. При резистентной к стандартным схемам лечения гонорее рекомендовано использовать комбинацию азитромицина с высокими дозами цефтриаксона. В России гонококк также практически резистентен к фторхинолонам, но пока сохраняет 100 %-ную чувствительность к цефтриаксону.
Как это происходит?
Механизмы антибиотикорезистентности уже давно привлекают внимание ученых. Если бы удалось взять под контроль эти процессы, проблема стойкости патологических микроорганизмов была бы решена
В настоящее время выявлено, что довольно часто явление наблюдается по причине модификации антимикробного состава. Форма при этом преобразуется в неактивную. К примеру, такое возможно, если микроорганизм генерирует некоторый фермент, вступающий в химическую реакцию с лекарственным соединением.
Классический пример: стафилококк способен продуцировать бета-лактамазу. Это вещество влияет на бета-лактамное пенициллиновое кольцо, размыкая его и делая препарат безопасным для возбудителя болезней.
Многие грамотрицательные формы жизни показывают повышенную стойкость к аминогликозидам. Это объясняется их способностью генерировать фосфорилирующие, ацетилирующие соединения, разрушающие молекулу антимикробного вещества. Также грамотрицательные возбудители могут продуцировать ацетилтрансферазу, которая деактивирует хлорамфеникол.
Проблема антибиотикорезистентности
Значение проблемы антибиотикорезистентности подтверждается многими исследованиями. Согласно данным, опубликованным в 2014 году, при сохраняющихся темпах роста антибиотикорезистентности суммарные потери общемирового ВВП к 2050 году составят более 100 триллионов долларов, а количество случаев преждевременной смерти людей в два раза превысит численность населения России .
Монорезистентные организмы становятся полирезистентными, а затем и панрезистентными. Появилось понятие так называемых “проблемных” микроорганизмов, среди которых особенно часто, особенно в условиях стационара, где широко применяются АМП и дезинфектанты, встречаются штаммы, резистентные к тем или иным (ко всем известным) АМП. К таким микроорганизмам относятся Staphylococcus spp., Enterococcus spp., Pseudomonas aeruginosa, Acinetobacter spp., ряд штаммов бактерий семейства Enterobacteriaceae.
Одной из наиболее важных причин сложившейся ситуации является доступность АМП населению во многих странах мира и высокая частота самолечения, которое очень часто является неадекватным. Так, по данным Европейского центра по профилактике и контролю заболеваний, около 40% европейцев уверены в том, что антибиотики эффективны при простуде и гриппе.
Свой вклад в усугубление проблемы, к сожалению, вносят и врачи. Недостаточная осведомленность клиницистов относительно правил рациональной АМТ, а иногда и неспособность устоять перед настойчивыми просьбами пациентов и их родителей приводят к неоправданному или неадекватному назначению АМП. Отсутствие просветительской работы с пациентами, в частности о необходимости завершения полного курса АМТ, становится причиной досрочного прекращения лечения. Все это способствует формированию и распространению устойчивых штаммов микроорганизмов.
Многими экспертами не раз уже отмечено, что хотя генерические препараты являются важным инструментом снижения общих затрат здравоохранения, по целому ряду из них отсутствуют адекватные исследования эффективности и безопасности по сравнению с оригинальными препаратами. Несколько исследований, проведенных в Российской Федерации, продемонстрировали наличие более низких концентраций активных субстанций в ряде “псевдогенериков”, что потенциально может приводить не только к снижению эффективности терапииу конкретного пациента, но и более быстрому росту резистентности к целому классу антибиотиков. В настоящее время рассматривается возможность внесения поправок к Федеральному закону №61. Согласно предложенным поправкам для регистрации новых генериков необходимо будет проводить исследование биоэквивалентности регистрируемого генерика по сравнению с оригинальным препаратом, а не любым уже зарегистрированным генериком.
Одной из основных проблем получения достоверных данных в бактериологических лабораториях России является недостаточно хорошее оснащение. Использование нестандартизированных сред и дисков с антибиотиками приводит к получению ложных результатов. В связи с этим значительное количество данных о чувствительности различных микроорганизмов к АМП не может быть использовано для проведения рациональной эмпирической АМТ
Следует также с осторожностью относиться к публикациям в отечественных и зарубежных источниках, в которых отсутствует информация о методах определения чувствительности и критериях интерпретации результатов. Необходимо помнить о том, что данные, полученные в зарубежных странах, могут существенно отличаться от российских, поэтому их нельзя использовать для выбора АМП.
Ситуацию также усугубляет недостаточный контроль за использованием АМП в ветеринарии и сельском хозяйстве. Применение антибиотиков в животноводстве в качестве добавки в корм для скота в малых дозах для стимулирования роста является общепринятой практикой во многих промышленно развитых странах и, как известно, приводит к повышению уровня резистентности микроорганизмов. Сельскохозяйственные животные могут служить резервуаром антибиотикорезистентных бактерий Salmonella spp., Campylobacter spp., Escherichia coli, Clostridium difficile, Staphylococcus aureus (MRSA), Enterococcus faecium (VRE) .
В настоящее время учитывая потенциальное развитие антибиотикорезистентности, АМП теряют коммерческую привлекательность, что находит подтверждение в отрицательной динамике появления новых системных антибиотиков (рис. 1).
Как бактерии приобретают устойчивость?
Антибиотики помогают при лечении инфекций, пока на бактерии есть «мишени» для действия препарата. «Мишенью» может быть компонент клеточной стенки или какой-либо фермент, участвующий во внутриклеточных процессах бактерии. Эффективность антибактериального лечения снижается по нескольким причинам.
Мутация
На клеточной стенке возбудителей существуют так называемые пенициллинсвязывающие белки. Они участвуют в процессе образования клеточной стенки микробов. Именно эти белки являются «мишенью» для действия антибиотика.
В процессе эволюции бактерии мутируют, а структура белка изменяется. Чем сильнее отличается новый белок от старого, тем менее эффективно антибактериальное лечение.
Бактерии научились удалять препарат
Даже проникнув внутрь клетки, антибиотик может не подействовать. В бактериях есть транспортные белки, которые выводят все препараты из клетки, как наш организм, например, удаляет вредные вещества через почки. Это явление у микробов называется эффлюксом или активным выведением.
Бактерии перешли в атаку
Чтобы высокие дозы антибиотика не могли разрушить и даже замедлить рост бактерий, последние стали выделять токсины в ответ. Например, чтобы пенициллин не нарушал процесс сборки бактериальной стенки, микробы продуцируют бета-лактамазу. Этот фермент связывается с пенициллином и инактивирует его.
Микробы установили «фейсконтроль»
Многие антибиотики действуют не на клеточную стенку бактерий, а на ее внутренние процессы. Чтобы проявить свой противомикробный эффект, молекула препарата должна проникнуть через мембрану возбудителя. Обычно антибиотики проникают прямо через стенку микроба. Но существует особая группа бактерий, у которых есть дополнительный защитный слой в стенке – липополисахаридные «трубочки». Антибиотик не может преодолеть этот слой, поэтому направляется к порам, через которые в клетку бактерии попадают питательные вещества и выделяются продукты ее жизнедеятельности. Многие микробы научились суживать эти коридоры, чтобы крупные молекулы антибиотика не могли пройти внутрь.
Бактерии нашли другой способ питания
Некоторые антибактериальные средства «притворяются» химическим соединением, которое необходимо микробам для обмена веществ. Проникая внутрь клетки под видом «стройматериала», антибиотик встраивается в ее метаболизм. Но из-за «диверсанта» бактерии собирают свои белки неправильно, что приводит к гибели возбудителей. Если микроб находит новый источник питания, он перестает реагировать на антибиотик, который был похож на его «еду».
Обмен опытом
Способность не поддаваться действию антибиотиков сохраняется в геноме бактерии в виде гена резистентности или r-гена. R-ген передается всем потомкам выжившей бактерии после ее деления. Но оказалось, что информацию о том, как победить лекарство, бактерия передает не только дочерним клеткам, но и своим «соседям». Между двумя микробами образуется «мостик», через который переходит плазмид – переносчик фрагмента ДНК бактерии. Благодаря такой взаимной поддержке микробов мы можем столкнуться с проблемой тотальной устойчивости.
Устойчивость к аминогликозидам
Аминогликозиды, используемые в клин. практике, могут быть инактивированы за счет одной из следующих реакций: ацетилирования, фосфорилирования или аденилирования, каждая из которых катализируется ферментами, контролируемыми генами, находящимися в составе R-плазмид (табл.)
Таблица. Ферменты, кодируемые плазмидами, модифицирующие аминогликозидные антибиотики
Ферменты, кодируемые плазмидами и модифицирующие | Модифицируемые антибиотики |
3′-0-фосфотрансфераза | Неомицин, канамицин |
3″-0-фосфотрансфераза | Стрептомицин |
5″-0-фосфотрансфераза | Рибостамицин |
2″-0-фосфотрансфераза | Гентамицин |
2″-0-аденилтрансфераза | Гентамицин, тобрамицин |
4′-0-аденилтрансфераза | Амикацин, тобрамицин |
З»-0-аденилтрансфераза | Стрептомицин, спектиномицин |
6′-0-аденилтрансфераза | Стрептомицин |
6′-N-ацетилтрансфераза | Амикацин, тобрамицин |
2′-N-ацетилтрансфераза | Гентамицин, тобрамицин |
3′-N-ацетилтрансфераза | Гентамицин,тобрамицин |
Предполагается, что ферменты, модифицирующие аминогликозидные антибиотики, локализованы в клетке на внутренней мембране, т. к. они могут быть освобождены в среду при отмывании холодной водой бактерий, обработанных сахарозой и трис-ЭДТА. Присутствие на внутренней мембране бактерий ферментов, модифицирующих аминогликозидные антибиотики, предотвращает, вероятно, их транспорт к рибосомам, представляющим мишень действия этих антибиотиков. С другой стороны, предполагалось, что модификация аминогликозидного антибиотика приводит к его инактивации. Накапливается все больше данных о возможной роли модифицирующих ферментов в нарушении транспорта аминогликозидных антибиотиков в клетку. Действительно, имеются результаты, указывающие, что полная инактивация антибиотика под влиянием модифицирующего фермента не наступает, а вместе с тем бактерия оказывается устойчивой к его действию. Уровень устойчивости к аминогликозидным антибиотикам, обусловленный R-плазмидами (см. R-фактор), колеблется от 20 до 5000 мкг/мл.
Эти колебания определяются многими причинами. Известно, что штаммы R+-бактерий, инактивирующие стрептомицин и канамицин путем фосфорилирования, характеризуются более высоким уровнем устойчивости к этим антибиотикам, чем этот же штамм, несущий другую плазмиду и инактивирующий антибиотики путем аденилирования. Различия в уровнях устойчивости к аминогликозидным антибиотикам могут быть обусловлены разным уровнем ферментативной активности, а именно: повышение последней может быть результатом увеличения в клетке числа копий плазмиды и, следовательно, числа генов, кодирующих модифицирующий фермент. Снижение уровня устойчивости к антибиотику может возникнуть в результате нарушения процесса выражения гена, определяющего устойчивость к данному антибиотику. Это часто наблюдают при переносе R-плазмиды из бактерии одного вида в бактерию другого вида. Расшифровка биохим, механизмов инактивации антибиотиков послужила стимулом для поиска новых препаратов, устойчивых к действию известных ферментов, определяющих резистентность бактерий. Так, напр., гентамицин, тобрамицин, ливидомицин А и Б активны в отношении бактерий, устойчивых к неомнцину и канамицину. Это определяется тем, что ферменты фосфорилирования, инактивирующие неомицин и канамицин, модифицируют 3′-OH группу аминогексозы, к-рая отсутствует в молекуле гентамицина и других упомянутых антибиотиков.
Заключение
Современная медицина немыслима без АМТ. Антибиотики во много раз сократили смертность от инфекционных заболеваний, смягчили тяжесть их течения, уменьшили количество постинфекционных осложнений. Однако, несмотря на появление в арсенале врачей значительного перечня лекарственных препаратов, активных в отношении практически всех патогенных микроорганизмов, существует значительное количество проблем и нерешенных вопросов в области АМТ .
В течение последних десятилетий АМТ инфекционных заболеваний существенно осложняется резистентностью возбудителей к АМП. Постоянный рост резистентности к АМП отмечен среди возбудителей как нозокомиальных, так и внебольничных инфекций. Возникновение резистентности и распространение ее среди микроорганизмов является естественным процессом, возникшим в ответ на широкое использование АМП в клинической практике, однако имеет большое социально-экономическое значение и в развитых странах рассматривается как угроза национальной безопасности. Инфекции, вызванные резистентными штаммами микроорганизмов, отличаются более тяжелым течением, чаще требуют госпитализации и увеличивают продолжительность пребывания в стационаре, ухудшают прогноз для пациентов.
Специалисты в области АМТ выделяют несколько уровней резистентности к АМП глобальный, региональный и локальный. Прежде всего, необходимо учитывать глобальные тенденции в развитии резистентности. Примерами микроорганизмов, у которых во всем мире стремительно распространяется резистентность к АМП, являются Staphylococcus spp., Enterococcus spp, Streptococcus pneumoniae, Neisseria gonorrhoeae, Pseudomonas aeruginosa, Acinetobacter spp., бактерии семейства Enterobacteriaceae и другие. При этом следует помнить, что резистентность не является тотальной. Так, например, Streptococcus pyogenes сохраняет чувствительность к пенициллину.
При планировании политики АМТ внебольничных инфекций следует более рационально опираться на локальные (региональные) данные, полученные в конкретной стране или регионе страны. В Российской Федерации существуют значительные территориальные вариации частоты резистентности возбудителей вне больничных инфекций к АМП. Вот почему необходимы постоянный мониторинг резистентности и информирование врачей различных специальностей. Наряду с региональными данными по резистентности к АМП внебольничных возбудителей в каждом ЛПУ необходимо иметь данные по резистентности нозокомиальных возбудителей, особенно в отделениях с интенсивным использованием АМП: ОРИТ, отделения хирургической инфекции, травматологии и ортопедии .
Хотя от адекватных назначений врачей и отказа пациентов от самолечения во многом зависит успех борьбы с проблемой антибиотикорезистентности, этих шагов, к сожалению, недостаточно. Очень многие решения должны быть приняты на национальном уровне, например, запрет на безрецептурный отпуск антибиотиков, усиление законодательства в отношении предотвращения производства и продажи фальсифицированных АМП, снижение применения антибактериальных средств в продовольственном животноводстве. Следует также отметить, что современные тенденции развития фармацевтической промышленности таковы, что гарантий появления новых групп АМП нет .








Добавить комментарий